مدیریت بیماری اماس
مدیریت بیماری اماس به مجموعهای از روشهای درمانی گفته میشود که با کمک آنها میتوان به درمانِ علامتی بیماری اماس پرداخت و نشانهها و عوارض آن را کنترل و مدیریت نمود. هدف از مدیریت بیماری اماس آن است که تا حد امکان، فردِ مبتلا، عاری از علائم باقی بماند و جلوی پیشرفت بیماری و همچنین بروز عواقب آن گرفته شود. دلیلِ اهمیت مدیریت بیماری اماس، پیچیدگیهای این بیماریِ پیشرونده و انواع گوناگون آن است که هر یک سیر متفاوتی دارند.
اماس یک بیماری میلینزدای التهابی مزمن است که دستگاه عصبی مرکزی را مبتلا میکند. شیوههای درمانی گوناگونی برای این بیماری وجود دارد، اما هیچیک از آنها قطعی نیست. این بیماری معمولاً به صورت «عودکننده-بهبودیابنده» پدیدار میشود که ویژگیاش، حملات غیرقابل پیشبینی (عود) و سپس دورههایی از بهبود نسبی، بدون حضور علائم و نشانههای بیماری است. پس از گذشت چند سال، بسیاری از کسانی که بیماریشان اینگونه آغاز شده، شروع به زوال مغزی-عصبی میکنند؛ بدون آنکه دورههای حاد عود وجود داشته باشد. چنین حالتی را «اماس ثانویهٔ پیشرونده» مینامند. حالات نهچندان شایع دیگرِ اماس، «بیماری اولیه پیشرونده» (زوال عصبی بدون وقوع حملات حاد) و «عودکنندهٔ پیشرونده» (زوال عصبی پایدار، بههمراه حملات حاد گاهبهگاه) هستند. برای هر یک از حالات فوق و همچنین برای کسانی که دچار گونهای از بیماری میلینزدا هستند اما تشخیص بیماریشان، اماس نیست، روشهای متفاوتی جهت درمان و ادارهٔ بیماری و عوارض آن موجود است. هدف اولیهٔ این روشهای درمانی، بازگرداندن کارایی فرد بهدنبال حملات، جلوگیری از حملات جدید و جلوگیری از ناتوانی است.
همچون تمامی درمانهای پزشکی، داروهای بهکاررفته در درمان این بیماری نیز ممکن است با عوارض گوناگونی همراه باشند. روشهای درمانی جدیدی نیز در دست پژوهش و بررسی است؛ از جمله درمان با سلولهای بنیادی. در همین حال، بسیاری از مبتلایان به اماس، بهدنبال درمانهای جایگزین هستند؛ هرچند مطالعات اثباتکننده، قابل مقایسه و همسان چندانی در زمینهٔ کارایی چنین درمانهایی در دست نیست.
کنترل حملات حاد
تجویز کورتیکواستروئیدهای وریدی همچون متیل پردنیزولون یک درمان رایج در عود کردنِ حاد بیماری است. این داروها طی یک دورهٔ سه تا پنجروزه تجویز میشوند و کاراییشان در بهبود سریع ناتوانی پس از حملات حاد، اثبات شدهاست. با این وجود، در مورد کارایی این داروها بر روی ناتوانیهای ناشی از اماس در درازمدت، شواهد اندکی موجود است. تجویز کورتیکواستروئیدهای خوراکی نیز اثرات درمانی و عوارض مشابهی دارد. حملات حاد اماس که به کورتونتراپی پاسخ نمیدهند، با پلاسمافرزیس قابل درمانند.
درمانهای تعدیلکنندهٔ بیماری
تا سال ۲۰۱۷ میلادی، چندین درمان تعدیلکنندهٔ بیماری توسط آژانسهای نظارتیِ کشورهای مختلف همچون سازمان غذا و داروی آمریکا، آژانس دارویی اروپا و آژانس دارو و تجهیزات پزشکی وزارت بهداشت، کار و رفاه ژاپن تأیید شدهاست.
داروهایی که توسط سازمان غذا و داروی آمریکا تأیید شدهاند، یازده موردند: اینترفرون بتا-۱ای و اینترفرون بتا-۱بی، سه پادتن مونوکلونال: ناتالیزومب، آلمتوزومب،اوکرلیزومب، و پنج تعدیلکننده دستگاه ایمنی: گلاتیرامر استات، میتوکسانترون، فینگولیمود، تریفلونوماید،دیمتیل فومارات و سیپونیمود. این داروها در مارس ۲۰۱۹ تأیید شدند.
داروی داکلیزومب که پیشتر مورد پذیرش قرار گرفته شده بود، امروزه مورد تأیید نیست.
داروها
در سال ۱۹۹۳ میلادی، اینترفرون بتا-۱بی نخستین دارویی بود که برای درمان اماس پذیرفته شد و بهدنبال آن، اینترفرون بتا-۱ای و گلاتیرامر استات هم تأیید شدند.
اینترفرون بتا-۱ای را برحسب نوع فرمولبندی شیمیایی، هفتهای یکبار بهصورت عضلانی یا هفتهای سه مرتبه بهصورت زیرجلدی تزریق میکنند. اینترفرون بتا-۱بی را بهصورت زیرجلدی و یک روز در میان تزریق میکنند. در سال ۲۰۱۴، یک فرم پگیلهشده از اینترفرون بتا-۱ای با نام تجاری «پلگریدی» بهمنظور تزریق زیرجلدی عرضه شد. در این نوع دارو، پلیاتیلن گلیکول را به مولکولهای اینترفرون متصل کردهاند تا اثرات بیولوژیک آن در بدن، به مدت بیشتری برقرار باشد و زمان تزریق نیز به دوهفته یکبار افزایش یابد.اینترفرون بتا تولید مواد التهابزا و ضدالتهاب را در مغز متعادل کرده و تعداد سلولهای التهابی عبوری از سد خونی مغزی را کاهش میدهد. در مجموع، درمان با اینترفرون بتا منجر به کاهش التهاب یاختههای عصبی (نرونها) میگردد. علاوه بر اینها، اینترفرون تولید فاکتور رشد عصب را تشدید کرده و احتمال بقای نرونها را افزایش میدهد.
گلاتیرامر استات، مخلوطی غیر یکدست از پلیمرهای چهار اسیدآمینه است که از لحاظ آنتیژنی شبیه به پروتئین اصلی میلین هستند و با آن، جهت عرضه به لنفوسیتهای تی رقابت میکند. این دارو بهصورت زیرجلدی و روزانه تزریق میشود.
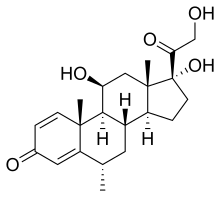
میتوکسانترون یک داروی سرکوبکننده سیستم ایمنی است که در شیمیدرمانی سرطان هم کاربرد دارد و در سال ۲۰۰۰ میلادی برای درمان اماس پذیرفته شد.ناتالیزومب یک پادتن مونوکلونال است که نخستین بار در سال ۲۰۰۴ میلادی تأیید شد. هردو دارو بهشکل تزریق آهستهٔ وریدی، و بهصورت ماهیانه برای ناتالیزومب و سههفته یکبار برای میتوکسانترون تجویز میشوند. در سال ۲۰۱۰، فینگولیمود که یک متعادلکننده گیرندهٔ اسفنگوزین-۱-فسفات ۱ است، نخستین داروی خوراکیای بود که مورد پذیرش سازمان غذا و داروی آمریکا قرار گرفت و بهدنبال آن، داروی تریفلونوماید تأیید شد که مهارکننده ساخت پیریمیدین است و واکنش سلولهای عرضهکنندهٔ آنتیژن را با لنفوسیتهای تی مختل میکند. فینگولیمود و تریفلونوماید به صورت تکدوز و روزانه مصرف میشوند. در سال ۲۰۱۳، یک داروی خوراکی دیگر، دیمتیل فومارات یا بیجی۱۲ (که نسخهٔ ارتقاءیافته از داروی قدیمی فوماریک اسید است) توسط سازمان غذا و داروی آمریکا تأیید شد. دیمتیل فورات دو بار در روز مصرف میشود.
یک داروی خوراکی دیگر بهنام کلادریبین در سال ۲۰۱۰ میلادی، در کشورهای روسیه و استرالیا پذیرفته شد اما با آنکه این دارو اثرات درمانی امیدوارکنندهای داشت، سازمان غذا و داروی آمریکا و آژانس دارویی اروپا بهسبب نگرانیهای ایمنی و عوارض دارویی از پذیرش آن سر باز زدند. این موضع سبب شد تا شرکت تولیدکنندهٔ آن، تبلیغات دارو را متوقف و درخواستهای بازاریابی آن را پس بگیرد.
بیشتر داروهای یادشده برای درمان نوع «عودکننده-بهبودیابنده» اماس پذیرفته شدهاند.
عوارض دارویی
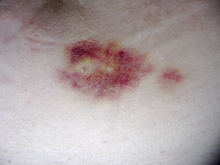
اینترفرونها و گلاتیرامر استات فقط فرم تزریقی دارند و هر دو در محل تزریق، بهویژه در موارد تزریق زیرجلدی، واکنشهای پوستی ایجاد میکنند. این واکنشهای جلدی، تظاهرات بالینی متفاوتی دارند و ممکن است شامل قرمزی، درد، خارش، تحریک پوستی، تورم و در موارد شدید، نکروز جلدی شوند. بیشتر این عوارض پوستی در ماه اول تجویز ظاهر میشوند و پس از شش ماه، میزان بروز و اهمیت آن کاهش مییابد. واکنشهای پوستی خفیف، مانعی برای ادامهٔ درمان نیستند اما نکروز جلدی که در حدود ۵٪ بیماران رخ میدهد، قطع درمان را در پی خواهد داشت. همچنین با گذشت زمان، ممکن است یک فرورفتگی قابل رویت در محل تزریق بهسبب تخریب موضعی بافت چربی (موسوم به لیپوآتروفی) حاصل شود.
اینترفرونها که زیرردهای از سیتوکینها هستند، در جریان بیماریهایی نظیر آنفلوانزا در بدن ساخته میشوند و کارشان کمک به بدن در مبارزه با عفونت است. این مواد، مسئولِ بهوجود آمدن علائمی چون تب، دردهای عضلانی، خستگی و سردرد هستند. بسیاری از بیمارانی که داروی اینترفرون بتا دریافت میکنند، گزارش نمودهاند که چند ساعت پس از تجویز، علائم شبهآنفلوانزا پیدا کردهاند. این علائم معمولاً ظرف ۲۴ ساعت برطرف میشود و مربوط به افزایش موقت سیتوکینهاست. چنین واکنشهایی پس از گذشت سه ماه از درمان، دیگر رخ نمیدهد و علائم آنرا میتوان با مصرف داروهای ضدالتهاب غیراستروئیدی غیرنسخهای همچون ایبوپروفن که کاهشدهندهٔ درد و تب است، برطرف کرد.
یک عارضهٔ ثانویه و گذرای دیگر اینترفرون بتا، تغییرات عملکردی در علائم فعلی بیماری اماس است. این تغییرات مشابه همان تغییراتی است که در اثر گرما، تب و استرس در بیماران اماس پدید میآید (پدیده اوتهوف) و بیشتر ظرف ۲۴ ساعت اول درمان رخ میدهند، در ماههای اولیهٔ درمان شایعتر هستند و ممکن است چندین روز بهطول بینجامند. یکی از علائم مستعد برای بدتر شدن، گرفتگی و سفتی عضلانی است. همچنین اینترفرون بتا ممکن است سبب کاهش گلبولهای سفید (لکوپنی)، لنفوسیتها و نوتروفیلها (نوتروپنی) شود و عملکرد کبد را تحت تأثیر قرار دهد. در بیشتر بیماران، این عوارض خطرناک نیستند و پس از قطع دارو یا کاهش آنها، بهبود مییابند. با این همه، توصیه بر آن است که کلیه بیماران از طریق آزمایش خون و آزمون عملکرد کبد زیر نظر باشند، تا اطمینان حاصل شود که مصرف اینترفرونها بیخطر است.
گلاتیرامر استات معمولاً به خوبی تحمل میشود. پس از عوارض پوستی، شایعترین عارضه جانبی این دارو، «واکنشهای پس از تزریق» است که شامل گُرگرفتگی، احساس سنگینی سینه، تپش قلب، تنگی نفس و اضطراب است و معمولاً کمتر از سی دقیقه طول میکشند و نیاز به اقدام خاصی ندارند.
میتوکسانترون ممکن است سبب آسیب کبدی و تضعیف سیستم ایمنی بدن شود اما خطرناکترین عارضهٔ جانبی آن مسمومیت قلبی وابسته به دوز است. به همین دلیل است که توجه دقیق به نحوهٔ مصرف و رهنمودهای پایش بیمار ضرورت مییابد. از جملهٔ این موارد، انجام پژواکنگاری قلب و یک شمارش کامل خون پیش از شروع درمان است تا مشخص شود آیا این دارو، برای بیمارِ مورد نظر مناسب است یا خطرات آن بیش از حد است. توصیه شدهاست که میتوکسانترون، با بروز اولین نشانههای نارسایی قلب، عفونت یا نارسایی کبدی در جریان درمان، قطع شود. مشکلات قلبی (اغلب نارسایی سیستولیک قلب) در بیش از ۱۰٪ بیماران ظاهر میشود و میزان شیوع سرطان خون نیز، ۰٫۸٪ است.
اندکی پس از پذیرش ناتالیزومب، شرکت سازندهٔ آن با پس از دریافت گزارشهایی مبنی بر ابتلای سه بیمار دریافتکننده دارو به یک بیماری نادر اما خطرناک مغزی به نام لکوانسفالوپاتی چندکانونی پیشرونده، آنرا از بازار خارج کرد. این بیماری، یک عفونت فرصتطلب با علائم پیشروندهٔ عصبی است که در اثر همانندسازی و تزاید ویروس جیسی در یاختههای گلیال مغز ایجاد میشود. هر سه نفر، ناتالیزومب را در ترکیب با اینترفرون بتا-۱ای مصرف کرده بودند. پس از بازبینیهای ایمنی، ناتالیزومب در سال ۲۰۰۶ دوباره روانهٔ بازار شد تا بهصورت تکدارویی، برای درمان اماس و تحت یک برنامهٔ تجویزی خاص و نظارتشده مصرف شود. تا ماه مه ۲۰۱۱، بیش از ۱۳۰ مورد لکوانسفالوپاتی چندکانونی پیشرونده گزارش شد که تمام آنها، بیمارانی با بیش از یکسال مصرف ناتالیزومب بودند. با آنکه هیچیک از این آنها، ناتالیزومب را در ترکیب با داروهای دیگر استفاده نکرده بودند اما مصرف پیشین داروهای ضد اماس، خطر ابتلا به این عارضه را در دریافتکنندگان ناتالیزومب ۳ تا ۴ برابر میکند. شیوع تخمینی لکوانسفالوپاتی چندکانونی پیشرونده، ۱٫۵ مورد از هر ۱۰۰۰ مصرفکنندهٔ ناتالیزومب است. حدود ۲۰٪ از بیماران اماس که به لکوانسفالوپاتی چندکانونی پیشرونده مبتلا میشوند، میمیرند و بیشتر آنهایی که زنده میمانند، دچار ناتوانیهای شدید میگردند.
طی کارآزماییهای بالینی، مصرف فیگولیمود، عوارضی همچون فشار خون بالا، کندتپشی، تورم ماکولای چشم، بالا رفتن سطح آنزیمهای کبدی یا کاهش سطح لنفوسیتهای خون را در پی دارد. تریفلونوماید داروی بسیار کمخطری است اما برای رشد و تکامل جنین خطرناک است. شایعترین عارضهٔ جانبیِ دیمتیل فومارات در کارآزماییهای بالینی، گُرگرفتگی و مشکلات گوارشی بودهاست. این مشکلات اغلب خفیف بوده و ظرف ماه اول درمان شایعتر بودهاند. با آنکه دیمتیل فومارات موجب کاهش گلبولهای سفید خون شده و سطح این گلبولها میبایست در بیماران تحت نظر باشد اما هیچ گزارشی از عفونتهای فرصتطلب در این بیماران طی کارآزماییهای بالینی گزارش نشدهاست. علاوه بر این، فوماریک اسید در درمان پسوریازیس (یک بیماری خودایمنی دیگر) کاربرد دارد و اطلاعات بهدستآمده در زمینهٔ ایمنی این دارو طی ۱۴ سال مصرف، هیچگونه عوارض خطرناک جانبی نشان ندادهاست.
سندرم بالینی منفرد
نخستین نشانههای بالینی نوع «عودکننده-بهبودیابنده» اماس، وضعیتی است که به آن سندرم بالینی منفرد می گویند. در آغاز این سندروم، تنها «یک حمله» از یک «علامت عصبی خاص» رخ میدهد. طی این وضعیت، حملات ضعیف و تحتحادی وجود دارد که گویای آغاز تخریب غلاف میلین است اما هنوز به آن حدی نرسیده که در تعریف و معیار بیماری اماس بگنجد. درمان با اینترفرون یا گلاتیرامر استات پس از بروز تکحملههای اینچنینی، خطر ابتلا به اماس بالینی را در آینده کاهش میدهد.
اماس عودکننده-بهبودیابنده
مصرف دارو برای این نوع از اماس تا حد قابلقبولی در کاهش حملات و کاهش تجمیع ضایعات مغزی مؤثر است. این تاثیرات با استفاده از تصاویر تقویتشده با گادولینیم در امآرآی (امآرآی با کُنتراست) قابل مشاهده و پیگیری است. اینترفرون و گلاتیرامر استات، تأثیر تقریباً یکسانی (در حدود ۳۰٪) در کاهش عودها دارند و بهسبب بیخطری نسبیشان، بهترین داروهای خط اول درمانند. با این حال، حدود ۳۰٪ از بیماران به این درمان پاسخ نمیدهند. یکی از دلایل این موضوع، وجود مقدار بسیار زیادی از پادتن خنثیکنندهٔ اینترفرون در خون این افراد است. معمولاً در ۵ الی ۳۰٪ از بیماران، مصرف اینترفرون، بهخصوص اینترفرون بتا-۱بی، موجب تولید پادتنهای خنثیکننده در ۶ ماههٴ دوم درمان میشود. افزون بر این، معمولاً، زیرگروهی از بیماران عودکننده-بهبودیابنده که اماس فعال دارند و گاهی بیماریشان را «اماس سریعاً وخیمشونده» میگویند، به تعدیلکنندههای ایمنی پاسخ نمیدهند و باید با میتوکسانترون یا ناتالیزومب درمان شوند.
میتوکسانترون یا ناتالیزومب، چه در زمینهٔ کاهش میزان عود و چه در زمینهٔ توقف روند معلولیت، بسیار مؤثرند اما عوارض جانبی خطرناکی هم دارند و بههمین دلیل آنها را خطِ دوم درمان در نظر میگیرند. ناتالیزومب در مقایسه با اینترفرون، خطر عود بیماری را نصف میکند و کارایی کلی آن بیش از ۷۰٪ است. علاوه بر این، میتوکسانترون در کاهش میزان حملات و پیشگیری از معلولیت بسیار مفید است اما بهدلیل احتمال بروز سمیت قلبی، بهمدت طولانی تجویز نمیشود.
داروهای خوراکی تعدیلکنندهٔ بیماری، جدید هستند و بههمین دلیل، هنوز دستورالعمل رسمی مشخصی برای استفادهشان موجود نیست. با آنکه برخی احتمال میدهند مصرف این داروها ممکن است مصرف داروهای خط اول درمان را کاهش دهد اما بیخطری نسبی مصرفِ درازمدتِ اینترفرون و گلاتیرامر استات، این روند را آهسته خواهد کرد. توصیهٔ فعلی آن است که درمان خوراکی تنها به دلایلی همچون سوزنهراسی و قادر نبودن بیمار به تزریق یا بیاثر بودن اینترفرون و گلاتیرامر استات در بدن بیمار تجویز شود. داروهای خوراکی را همچنین میتوان برای کسانی تجویز کرد که پس از مصرف ناتالیزومب، پادتنهای ضد ویروس جیسی در بدنشان مشاهده میشود و در معرض خطر لکوانسفالوپاتیِ چندکانونیِ پیشروندهاند. دیمتیل فومارات یکی از جالبترین داروهای خوراکی است؛ چون بهطور بالقوه، در درمانهای طولانیمدت —که از تجربهٔ استفاده در درمان پسوریازیس بهدست آمده— نمایهٔ بیخطری (Safety profile) بسیار خوبی دارد.
با آنکه مطالعات بیشتری برای اثرات درازمدت داروها، بهویژه داروهای جدیدتر، لازم است، اطلاعات موجود دربارهٔ اثرات اینترفرون و گلاتیرامر استات نشان دادهاست که آغاز زودهنگام این داروها و ادامهٔ درمان طولانیمدت با آنها بیخطر است و به نتایج بهتری منجر میشود. در مطالعات مختلف، داروهای ضدبارداری خوراکی، اثرات متناقضی در زمینهٔ کاهش میزان عود در زنان مبتلا به اماس از خود نشان دادهاند. برخی داروهای بهکار رفته در درمان علامتی اماس همچون کاربامازپین (برای درمان گرفتگی، اسپاسم و درد عضلات) و مدافینیل (برای درمان خستگی) موجب کاهش اثرات داروهای ضدبارداری خوراکی میشوند.
اماس پیشروندهٔ ثانویه و اماس عودکنندهٔ پیشرونده
درمان انواع پیشرفتهٔ اماس دشوارتر از نوع «عودکننده-بهبودیابنده» است. انواع متفاوتی از داروها بدین منظور بهکار گرفته شده تا سیر پیشرفت بیماری را کُند نماید اما نتایج بهدستآمده در بهترین حالت، «متوسط» بودهاست. میتوکسانترون نتایج مثبتی در درمان انواع «ثانویهٔ پیشرونده» و «عودکنندهٔ پیشرونده» داشتهاست. این دارو اثر متوسطی در کاهش پیشرفت بیماری و تواتر عودها پس از دو سال مصرف دارد. در سال ۲۰۰۷ میلادی، میتوکسانترون تنها دارویی بود که برای درمان اماس پیشروندهٔ ثانویه و اماس عودکنندهٔ پیشرونده در ایالات متحده آمریکا تأیید شد اما با این وجود بهدلیل ایجاد سمیت قلبی، مصرف طولانیمدت آن محدود است. این دارو در اروپا تأیید نشدهاست. ناتالیزومب نیز مؤثر بوده و برای درمان «اماس ثانویهٔ پیشرونده» بههمراه عودهای مکرر تأیید شدهاست. مطالعات انجامشده، کارایی اینترفرون بتا-۱بی را در کُند نمودن روند پیشرفت بیماری تأیید نمیکند اما این دارو، تعداد عودها را کاهش میدهد.
اماس پیشروندهٔ اولیه
درمان این نوع از اماس مسئلهساز و مشکل است؛ چرا که بسیاری از بیماران به هیچیک از درمانهای موجود پاسخی نمیدهند و هیچ درمانِ بخصوصی نیز برای آن تأیید نشدهاست. چندین کارآزمایی بالینی بهمنظور بررسی کارایی داروهای گوناگون در درمان اماس پیشروندهٔ اولیه انجام شده که هیچکدام نتیجه مثبتی نداشتهاست. داروهای آزمایششده شامل اینترفرون بتا، میتوکسانترون، گلاتیرامر استات و ریلوزول بود. مبتلایان به این نوع اماس، تحت کارآزمایی بالینی با آزاتیوپرین، متوترکسات، ایمونوگلوبولین وریدی، سیکلوفسفامید، سلولهای بنیادی خونساز، سیکلوفسفامید و پیوند مغز استخوان نیز قرار گرفتهاند.
مدیریت درمانی عوارض اماس
درمانهای تعدیلکنندهٔ بیماری تنها سرعت پیشرفت بیماری را کم میکنند اما جلوی پیشرفت را نمیگیرند. با پیشرفت اماس، علائم آن نیز تشدید میشود. اماس علائم و نقایص عملکردی گوناگونی در پی دارد که موجب اختلالات و معلولیت پیشرونده میشود. در نتیجه، مدیریت درمانی این نقایص بسیار مهم است.
بازتوانی
فیزیوتراپی و انواع توانبخشی عصبی، از روشهای به کار گرفته شده برای مدیریت عوارض اماس محسوب میشوند. اما تعیین این که کدام روش بازتوانی سودمندتر است، اغلب دشوار است؛ چون برنامهٴ درمانی اماس، معمولاً برای هر شخص خاص با شرایط و نیازهای خاصی که دارد، طراحی میشود.
فیزیوتراپی
بعضی از علائم اماس مانند خستگی، گرفتگی و سفتی عضلانی، افسردگی، اختلالات عملکردی مثانه و علائم عصبی، قابل بهبودند. این علائم را میتوان با دارو و فیزیوتراپی برطرف کرد. فیزیوتراپیستها ورزشهای تقویتی و کششی را به بیمار آموزش میدهند تا با تقویت و افزایش انعطافپذیری عضلات، انجام کارهای روزمره آسانتر و خستگی بیمار برطرف شود.
دارودرمانی و توانبخشی عصبی هردو، در کاهش بارِ علائم برای بیمار نقش دارند؛ هرچند هیچکدام قادر به جلوگیری از پیشرفت بیماری نیستند. برای علائم دیگر بیماری اماس، درمانهای کنونی اثربخشی ناچیز و محدودی دارند.
توانبخشی عصبی
با آنکه در زمینهٔ توانبخشی عصبی در اماس مطالعات اندکی صورت گرفته اما اثربخشی و کارایی آن در بیماریهایی چون سکته مغزی و ترومای سر اثبات شدهاست. برای درمان بیماران مغز و اعصاب، از جمله اماس، لازم است یک تیم پزشکی میانرشتهای برای غلبه بر ناتوانیهای احتمالی همکاری داشته باشند اما در مورد بیماران اماس، مشکل میتوان تعیین کرد که «تیم اصلی درمان» چه کسانی باید باشند؛ چون آنها در مراحلی از بیماری خود، به کمک و همیاری تمامی مشاغل و خدمات پزشکی نیازمندند.نورولوژیستها افراد اصلی در تشخیص و درمان اماساند، فرایند بازتوانی جامع و فراگیر بیماران اماس معمولاً توسط متخصصان پزشکی فیزیکی و توانبخشی انجام میشود و درمانهای یکپارچه و وابسته همچون فیزیوتراپی،گفتاردرمانی و کاردرمانی میتوانند برخی علائم را کنترل و کیفیت زندگی فرد را حفظ کنند. از سوی دیگر، درمان علائم «روانعصبی» همچون استرسهای روحی و اختلال افسردگی عمده میبایست توسط متخصصان بهداشت روانی همچون رواندرمانگرها، روانشناسها، روانپزشکان و عصبروانشناسان صورت پذیرد. عصبروانشناسان، همچنین میزان آسیب «نقایص شناختی» بیمار را ارزیابی و آنرا درمان و کنترل میکنند.
بهسبب کمبود کارآزماییهای تصادفی کنترلشده، شواهد اندکی از اثربخشی «تکدرمانی» موجود است اما ثابت شدهاست که همکاری میانرشتهای و تیمی برای مدیریت علائم، در افزایش سطح فعالیت و مشارکت بیمار مؤثر است. شواهدی وجود دارد که تایید میکند برخی درمانهای خاص مانند ورزش و نرمش، رواندرمانی —بهخصوص رفتاردرمانی شناختی— و دستورالعملهای حفظ انرژی در این زمینه کارایی دارند. مداخلات تخصصیتر روانشناختی در درمان افسردگی سودمندند اما برای سودمند بودن آن برای سایر موارد نظیر اختلالات شناختی، شواهد علمی چندان قوی نیست.
سلامت عمومی
پزشکی فیزیکی و توانبخشی میتواند با آموزش گام برداشتن صحیح، باعث کاستن از خستگی بیمار در هنگام راه رفتن شود و درنتیجه مشارکت او را در انجام کارهای روزمره افزایش دهد. این آموزش معمولاً بر روی زمین (مثلاً در باشگاه یا خارج از منزل و بر روی یک سطح ناصاف)، یا بر روی تردمیل و به در مواردی با استفاده از وسایل روباتیک انجام میشود. در بیمارانی که اختلالات حرکتی شدید پیدا کردهاند، بازتوانی روباتیک با مهار وزن بدن بر روی تردمیل، میتواند گزینهٔ مؤثری باشد. در مقابل، در مورد بیمارانی که اختلالات حرکتی کمتری دارند، آموزشهای روی زمین برای افزایش سرعت گامبرداشتن، بهتر است. درمانهای کمکی با استفاده از اسبسانان نظیر «اسبسواری درمانی» و «هیپوتراپی» (اسبدرمانی)، میتواند بر نحوهٔ صحیح گامبرداشتن بیمار، حفظ تعادل و بهبود کیفیت زندگی او اثر مثبتی داشته باشد.
در گذشته، به مبتلایان به اماس توصیه میشد ورزش نکنند تا مبادا علائمشان بدتر شود. با این وجود، زیر نظر یک متخصص، انجام فعالیتهای بدنی میتواند نه تنها بیخطر، بلکه سودمند باشد. پژوهشهای انجامشده نیز نقش بازتوانی ورزش و فعالیتهای بدنی را در افزایش قدرت ماهیچهها، تحرک، بهبود خلق، سلامت رودهها، آمادگی بدنی و کیفیت زندگی ثابت کردهاست. بسته به بیمار، این فعالیتهای فیزیکی شامل تمرینات استقامتی، راهپیمایی، شنا، یوگا، تایچی و غیره است. تعیین یک ورزش مناسب و بیخطر آسان نیست و باید برای هر بیمار، بهطور اختصاصی طراحی شود تا اطمینان حاصل شود که تمامی احتیاطهای لازم انجام شده و موارد ممنوعه در نظر گرفته شدهاست.
به دلایل مختلفی از جمله ورزش، دوش آب گرم، حمام آفتاب، افزایش دمای محیط یا حتی تغییرات شبانهروزی دمای بدن، ممکن است دمای مرکزی بدن افزایش یابد و برخی از علائم بیماری نمایان شود. بنابراین باید دقت کرد که حین ورزشدادن به بیماران اماس، دمای بدنشان بیش از حد بالا نرود. شواهد علمی نشان میدهد که روشها و راهکارهای خنکسازی، مانند دوش آب سرد، فروبردن دست و پاها در آب سرد، کیسهٔ یخ و نوشیدن مایعات سرد،کمک میکنند که بیمار بتواند بیشتر ورزش کند. این راهکارها، بعد و قبل از ورزش و همچنین در زمان قرار گرفتن بیمار در معرض گرما، کاربرد دارند. اثر متقابل افزایش دمای مرکزی بدن بر فرایند تخریب غلاف میلین، سبب انسداد موقت هدایت عصبی و ظهور موقتی اختلالات فیزیکی و نقص عملکرد شناختی میشود. تمام این وقایع در نهایت منجر به کاهش ایمنی بیمار و تواناییاش در انجام کارهای روزمرهٔ زندگی میشود اما تدابیر پیشگیری موفقیتآمیز و ماندگاری هم وجود دارد. راهکارهای رفتاری جهت کاهش دما همچون ورزش کردن در فضای باز در فصول سرد سال یا بهکارگیری دستگاه تهویه مطبوع و کولر یکی از این موارد است.
درمانهای پزشکی علائم بیماری
بیماری اماس علائم گوناگونی شامل تغییرات لامسه، ضعف عضلانی، اسپاسم غیرعادی ماهیچهها، اختلال حرکتی، مشکلات هماهنگی عضلات و تعادل، اشکالات گفتاری (دیسآرتری) و بلع (دیسفاژی)، تغییرات بینایی (نیستاگموس)، التهاب عصب بینایی یا دوبینی، خستگی، دردهای حاد یا مزمن، مشکلات مثانهای و رودهای، اختلالات شناختی و علائم هیجانی (بیشتر اختلال افسردگی عمده) ایجاد میکند. در عین حال، برای هر یک از این علائم، گزینههای درمانی گوناگونی موجود است. .درمانها میبایست بسته به بیمار و پزشک، شخصیسازی شوند.
- مثانه: اختلال عملکرد دستگاه ادراری در اماس شایع است. درمان این مشکلات بر حسب خاستگاه و نوع اختلال عملکردی، متفاوت است. اما کنترل مثانه، بیاختیاری ادرار و عفونت ادراری بیشتر شایعند. در مورد کنترل مثانه، داروهای مختلفی تجویز میشود؛ از جمله دسموپرسین برای شبادراری و داروهای آنتیکولینرژیک مثل اکسیبوتینین و تولترودین جهت «اضطرارِ ادراری». درمانهای غیر دارویی، شامل تمرینهای تقویت ماهیچههای دیافراگم لگنی، تحریک ماهیچههای لگن، شیافهای مهبلی، بازآموزی مثانه، تغییر در عادات روزانهٔ زندگی همچون نحوهٔ لباسپوشیدن، استفاده از وسایل جمعآوری خارجی ادرار برای مردان، نوار بهداشتی و نرمپوشهای ویژه بیاختیاری ادرار در زنان و استفادهٔ گاهبهگاه از سوند ادراری است. مصرف طولانی مدت و دائمی سوند ادراری میتواند باعث بروز عفونت ادراری شود، پس حتیالامکان باید از آن خودداری کرد. منشأ مستقیم برخی از این توصیههای علمی، مطالعات و پژوهشهای مربوط به اماس نیست؛ بلکه از توصیههای عمومی در بیماران مبتلا به مثانه نوروژنیک وام گرفته شدهاست.
- روده: مشکلات رودهای در ۷۰٪ بیماران اماس دیده میشود که در حدود ۵۰٪ آنها بهصورت یبوست و در ۳۰٪ آنها بهصورت بیاختیاری مدفوعی است. دلیل این مشکلات، کاهش حرکات لوله گوارش یا اختلال در کنترل عصبی دفع مدفوع است. مورد اخیر بهدلیل کمتحرکی یا مصرف برخی داروها بروز میکند. درد یا اشکال در دفع مدفوع را میتوان با تغییراتی در رژیم غذایی همچون افزایش مصرف مایعات، استفاده از ملینها یا شیاف رفع کرد. هنگامی که این روشها کارساز نیستند، تنقیه انجام میشود.
- مشکلات هیجانی و شناختی: علائم روانعصبی در جریان اماس شایع است. در ۸۰٪ از بیماران، افسردگی و اضطراب وجود دارد. بیثباتی هیجانی، که منجر به گریههای غیرقابل کنترل میشود، بسیار دیده شدهاست. این علائم را میتوان با داروهای ضدافسردگی و رفتاردرمانی شناختی درمان کرد؛ اگرچه مطالعات باکیفیت دربارهٔ اثربخشی آنها موجود نیست. بهعنوان مثال، بنیاد همیاری کاکرین تا سال ۲۰۱۱ تنها دو مطالعه را دربارهٔ استفاده از ضدافسردگیها در درمان افسردگی ارزشمند دانست که آنها هم اثربخشی کمی را نشان داده بودند. سایر علائم روانعصبی، شاملِ سرخوشی و مهارگسیختگی است. طی ۲۰ سال گذشته، با وجود معرفی داروهای تعدیلکنندهٴ بیماری، اختلالات شناختی یکی از عوارض شایع اماس بودهاست. گرچه خودِ اماس اغلب دلیل اصلی اینگونه عوارض است، اما دلایل دیگری همچون عوارض دارویی، عودها و افسردگی نیز میتوانند این اختلالات را تشدید کنند. پس، بررسی و ارزیابی دقیق آنها و عوامل تشدیدکنندهشان اهمیت دارد. دربارهٔ اختلالات شناختیِ اولیهٔ ناشی از اماس، اطلاعات علمی موجود نشان میدهد که تجویز لووآمفتامین و متیلفنیدات سودمند است، حال آنکه داروهای ممانتین و ضد استیلکولیناستراز نظیر دونپزیل، که بهطور معمول در بیماری آلزایمر بهکار میروند، در درمان این اختلالات مؤثر نیستند. اثربخشی بازتوانی شناختی، حتی بیشتر از کارایی داروها مورد بحث و اختلاف است. در آن دسته از مبتلایان اماس که ناخویشتنداری عاطفی دارند (که مشخصهاش گریهها یا خندههای غیرقابل کنترل یا سایر تظاهرات هیجانی است)، تجویز دکسترومتورفان/کینیدین میتواند مؤثر باشد. این دارو، تنها دارویی است که سازمان غذا و داروی آمریکا بدینمنظور تأیید کردهاست. با این حال، گاهی در عمل، از بازدارندههای بازجذب سروتونین و ضدافسردگیهای سهحلقهای نیز استفاده میشود.
- مشکلات گفتاری و بلع: دیسفاژی به اشکال در بلع غذا گفته میشود که ممکن است منجر به خفگی و آسپیراسیون ریوی غذا یا مایعات شود. دیسآرتری یک اختلال حرکتی گفتار است که مشخصهاش کنترل ضعیف بر روی ماهیچهها و سیستمهای فرعی دخیل در گفتار است. یک متخصص زبان و گفتاردرمانی، با استفاده از روشهای علمی و ارائه دستورالعملهای مناسب، میتواند بلع غذا و وفقپذیری با رژیمهای غذایی را بهبود دهد، تولید صدا و وضوح کلام را حفظ یا بهتر کند و یا نیز برای برقراری ارتباط، روشهای جایگزین را آموزش دهد. در موارد شدید و پیشرفتهٔ دیسفاژی، غذا از طریق لولههای بینی-شکمی، مستقیماً از بینی به درون معده فرستاده میشود. گاهی از «اتصال آندوسکوپیک لوله معده از سطح شکم» هم استفاده میشود و غذا مستقیماً از طریق این لوله بهدرون معده ریخته میشود.
- اختلال نعوظ: اختلال نعوظ یکی از مشکلات مردان مبتلا به اماس است. شواهدی در دست است که نشان میدهد استفاده از سیلدنافیل ممکن است سودمند باشد.
- خستگی: خستگی یکی از عوارض بسیار شایع و ناتوانکنندهٔ اماس است و ارتباط نزدیکی با افسردگی در این بیماران دارد. زمانی که افسردگی این بیماران کم میشود، خستگی هم نسبتاً بهبود مییابد. پس، قبل از هرگونه اقدام درمانی برای رفع خستگی، باید بیمار را از لحاظ افسردگی ارزیابی کرد. اختلالات خواب، درد مزمن، تغذیهٔ نامناسب و حتی بعضی از داروها میتوانند سبب خستگی شوند. اگرچه داروهایی مثل آمانتادین،پمولین،مدافینیل و همچنین مداخلات روانشناسانهٔ حفظ انرژی جهت درمان خستگی مطالعه شده؛ اما تأثیرگذاری آنها اندک بودهاست. خستگی یکی از دشوارترین علائم برای درمان است و هیچ داروی خاصی برای آن توصیه نمیشود.
- درد: درد حاد، بیشتر ناشی از التهاب عصب بینایی است که بهترین درمان موجود برای آن، تجویز کورتیکواستروئید است. از دیگر دلایل میتوان به نورالژی عصب سهقلو، علامت لرمیت یا دیسستزی (حس غیرطبیعی) اشاره کرد. دردِ تحتحاد ثانویه به خودِ بیماری است و بهدلیل ماندن در یک وضعیت ثابت، احتباس ادراری، زخمهای عفونیشدهٔ پوست و غیره رخ میدهد. درد مزمن بسیار شایع و درمانش بسیار مشکل است؛ چون مهمترین دلیلش دیسستزی است. دردهای حاد ناشی از نورالژی عصب سهقلو را میتوان با داروهای ضد تشنج نظیر کاربامازپین یا فنیتوئین درمان کرد. علامت لرمیت و دیسستزی دردناک معمولاً به درمان با کاربامازپین، کلونازپام و آمیتریپتیلین پاسخ میدهند. در برخی کشورها، داروی ساتیوکس برای درمانِ درد در مبتلایان اماس پذیرفته شدهاست اما از آنجایی که این دارو از ماریجوآنا بهدست میآید، در برخی کشورها همچون ایالات متحده آمریکا در دسترس نیست. این دارو برای کنترل و درمان برخی دیگر از علائم اماس، نظیر گرفتگی و سفتی عضلات هم در دست پژوهش است و ثابت شده که در درازمدت، مصرفش بیخطر و اثرگذار است.
- گرفتگی و سفتی عضلانی (اسپاسیته): مشخصهٔ «اسپاسیته»، سفت شدن عضلات، آهسته شدن حرکات اندام، شکلگیری وضعیت بدنی خاص، ضعف در قدرت ماهیچههای ارادی بدن و اسپاسم غیرارادی و بعضاً دردناک دست و پاست. فیزیوتراپیستها میتوانند به اقداماتی نظیر «کششهای پاسیو» به کاهش اسپاسیته و جلوگیری از بروز بدشکلی بدن کمک کنند.نابیکسیمولس دارویی بیخطر و مؤثر در بهبود سفتی و گرفتگی عضلانی است. شواهدی محدود و اندک مبنی بر اثرگذاری باکلوفن،دانترولین،دیازپام و تیزانیدین موجود است. در موارد شدید این عارضه، میتوان از تزریق داخلنخاعی باکلوفن استفاده کرد. همچنین چند روش تسکینی همچون ریختهگری، آتلبندی یا استفاده از صندلیهای مخصوص در دسترس است.
- بینایی: داروهای گوناگون، عینک و لنز و سایر سیستمهای جبرانی چشمی برای بهبود نیستاگموس و دوبینی بهکار میروند. در برخی موارد نیز جراحی انجام میشود.
- راهرفتن: ۴-آمینوپیریدین یک مسدودکنندهٔ فراگیر کانالهای پتاسیمی است که توسط سازمان غذا و داروی آمریکا پذیرفته شدهاست و برای درمان اختلالات گام و مشکلات راهرفتن در بیماران اماس بهکار میرود. ثابت شده که این دارو، سرعت راهرفتن فرد را بالا میبرد. اما چون قیمتش گران (ماهیانه بیش از ۱۰۰۰ دلار آمریکا) است، مصرفش محدود است.
متأسفانه سایر علائم نظیر آتاکسی، لرزش و از دست رفتن لامسه درمان اثباتشدهای ندارند.
پژوهشها

سمت و سوی پژوهش در درمان بیماری اماس، بهسمت تحقیق دربارهٔ دلایل پاتولوژیک بیماری و ناهمگنی آن، پژوهش دربارهٔ یافتن درمانهای مؤثرتر، آسانتر و قابلتحملتر برای نوع «عودکننده-بهبودیابنده»، یافتن درمان برای انواع پیشروندهٔ بیماری، راهکارهای محافظت از اعصاب و پژوهش برای یافتن درمانهای علامتی مؤثر است.
پیشرفتهای دههٔ گذشته، منجر به پذیرش چندین داروی خوراکی در سالهای اخیر شدهاست. انتظار میرود که استقبال از این داروها در مقایسه با داروهای قدیمی بیشتر شود. چند داروی خوراکی دیگر در دست تحقیق است که در اوت ۲۰۱۲ اعلام شد یکی از مهمترین آنها، لاکینیمود، بهدنبال نتایج ناهمسانی که در مطالعات اولیه داشته، وارد فاز سوم کارآزماییهای بالینی خواهد شد. همچنین، هدف از پژوهشهای دیگر، افزایش کارایی درمانهای فعلی با استفاده از ترکیبات دارویی جدید است. یک نمونه از اینها، فرم پگیلهشده اینترفرون بتا-۱ای است که نیمهعمر بیشتری از اینترفرون معمولی دارد و متخصصان مشغول بررسی این موضوع هستند که اگر آنرا با توالی کمتری تجویز کنند، آیا همان کارایی را خواهد داشت یا خیر. با با کامل شدن یک مطالعهٔ دوسالهٔ بزرگ و مهم، مشخص شد که فرم پگیلهشده اینترفرون بتا-۱ای در مقایسه با پلاسیبو، اثربخشی زیادی در کاهش عودها و پیشرفت ناتوانی دارد.
پادتنهای مونوکلونال که داروهای همخانوادهٔ ناتالیزومب هستند، توجه پژوهشگران را بهمیزان زیادی بهخود جلب کردهاند. آلمتوزومب، داکلیزومب، CD20، ریتوکسیمب، اوکرلیزومب و اوفاتومومب همگی تا حدودی سودمند و برای درمان اماس در دست پژوهشند. با این حال، استفاده از اینها با بروز عوارض بالقوه خطرناک همراه بودهاند که مهمترینشان عفونت فرصتطلب است. در همین ارتباط، اخیراً آزمایشی برای پادتنهای ویروس جیسی ساخته و تکمیل شده که قادر است پیشبینی نماید کدام بیماران در صورت مصرف ناتالیزومب، در معرض ابتلا به «لکوانسفالوپاتی چندکانونی پیشرونده» هستند. با آنکه پادتنهای مونوکلونال در درمان اماس در آینده نقش خواهند داشت، اما گمان بر آن است که بهدلیل عوارض خطرناکشان، این نقش اندک خواهد بود.
یک خط مشی پژوهشی دیگر، بررسی اثربخشی ترکیب دو یا چند دارو با هم است. پایهٔ منطقی درمان چند دارویی، آن است که این داروها، مکانیسمهای متفاوتی از بیماری را هدف قرار میدهند و درنتیجه اثرشان انحصاری نیست. افزون بر این، ممکن است همافزایی دارویی رخ دهد و یک دارو اثر داروی دیگر را تقویت کند. با این وجود، کاستیهای مهمی نیز ممکن است رخ دهد؛ نظیر اثر خنثیکنندگی یک دارو بر روی داروی دیگر، یا تقویت اثرات زیانآور ثانویه. با آنکه چندین کارآزمایی بالینی دربارهٔ درمان چند دارویی انجام شدهاست، در هیچکدام از آنها، اثربخشی قابلقبولی که اینگونه درمانها را بهعنوان روشی موفقیتآمیز و بادوام مورد اعتنا قرار دهد، مشاهده نشدهاست.
همچنین هیچ درمان مؤثری برای انواع پیشروندهٔ بیماری موجود نیست. بسیاری از داروهای جدید و آنهایی که در دست تحقیق و بررسی هستند، احتمالاً برای انواع «عودکننده-بهبودیابنده» و «پیشروندهٔ ثانویه» بهکار خواهند رفت و در صورت نشان دادن کارایی بهتر در مقایسه با درمانهای قدیمیتر، تنها در این گونه بیماران اثرگذاری مثبت خواهند داشت.
پیشرفتهای زیادی نیز در حوزهٔ تصویربرداری پزشکی و امآرآی در حال شکلگیری است که این امکان را فراهم میآورد تا متخصصان، درک بهتری از بیماری داشته باشند و بررسی دقیقتری بر روی بیماران مبتلا به اماس انجام دهند و هر بیمار را، با روشی مؤثرتر درمان کنند.
پیوند سلولهای بنیادی
با اینکه پژوهشهای مهمی دربارهٔ روشهای درمانی حفاظت از سلولهای عصبی و بهویژه درمانهای احیاکننده و باززایشی (رژنراتیو) همچون درمان با سلولهای بنیادی در حال حاضر در جریان است، اما چنین درمانهایی تنها در آینده امکانپذیر خواهد بود. یک پژوهش در سال ۲۰۱۸ میلادی، نتایج امیدآفرینی در اماس «عودکننده-بهبودیابنده» نشان داد اما تحقیقات بیشتری در این زمینه لازم است.
CCSVI
در سال ۲۰۰۸ میلادی، یک جراح عروق ایتالیایی به نام پائولو زامبونی مدعی شد که یکی از دلایل اماس، فرایندی در دستگاه گردش خون بهنام «نارسایی مزمن وریدهای مغزی-نخاعی» است که طی آن، سیاهرگهایی از مغز دچار انقباض میشوند. او چنین مشکلی را در ۶۵ بیمارش که مبتلا به اماس بودند، پیدا کرده بود. نظریهٔ او در رسانهها و نزد مبتلایان بهاماس بهویژه در کشور کانادا مورد توجه فراوان واقع شد. نگرانی دربارهٔ نظریهٔ زامبونی آن بود که پژوهش او نه «کنترلشده» و نه «دوسویه کور» بود و فرضیهٔ او دربارهٔ علت بیماری، با اطلاعات علمی موجود همخوانی نداشت. پژوهشهای مشابه نتوانستند ارتباطی میان ایندو پیدا کنند یا آنکه ارتباط موجود بسیار ضعیف بود. بههمین سبب، اعتراضاتی به این فرضیه بهوجود آمد. روش «جراحی رهاسازی» او به سبب بروز احتمالی عوارض جدی و مرگ مورد انتقاد قرار گرفت و اثرات سودمند آن نیز ثابت نشد. در حال حاضر، توصیه میشود که تا زمانی که کارایی آن با مطالعات کنترلشده اثبات شود، از چنین روشی استفاده نشود. پژوهشهای انجامشده بر روی CCSVI از نوع «تسریعشده» بود، اما پژوهشگران نتوانستند ثابت کنند که CCSVI در بروز اماس نقش دارد.
درمانهای جایگزین
بیش از ۵۰٪ از مبتلایان به اماس ممکن است از درمانهای جایگزین و مکمل استفاده کنند؛ گرچه این آمار ممکن است بر حسب تعریفی که از درمان مکمل یا جایگزین موجود است، متفاوت باشد. بهعنوان مثال، تخمین زده میشود در ایالات متحده آمریکا، ۷۵٪ بیماران دستکم از یک روش جایگزین و مکمل برای درمان و کنترل علائم خود استفاده میکنند. شواهد علمی برای اثربخشی چنین درمانهایی، یا ناموجود و یا ضعیف است. مثالهایی از اینگونه درمانها، استفاده از مکملهای غذایی و رژیمهای تغذیهای خاص همچون ویتامین دی، کلسیم، ویتامین ب۱۲ و آنتیاکسیدانهاست. پایهٔ منطقی برای استفاده از مکملهای ویتامین دی آن است که پژوهشها نشان دادهاند که میان کمبود ویتامین دی و پیشرفت بیماری اماس ارتباطی موجود است؛ بهعلاوه آنکه ویتامین دی اثرات ضدالتهابی دارد.
دربارهٔ درمانهای آنتیاکسیدان، مطالعات نشان دادهاست که «گونههای واکنشپذیر اکسیژن» منجر به تشکیل ضایعات اماس میشوند و آنتیاکسیدانها میتوانند اثرات محافظتکننده عصبی و تعدیلکنندهٔ ایمنی داشته باشند. احتمالاً مشخصترین عامل تشدیدکنندهٔ بیماری اماس، مصرف سیگار است و ترک سیگار در بیماران اماس باید مد نظر باشد.
سایر درمانهای مکمل و جایگزین شامل روشهای تمدد اعصاب و آرامشزا همچون یوگا،گیاهدرمانی (از جمله مصرف ماریجوآنای طبی)، اتاقکهای اکسیژن با فشار بالا، خودآلودهسازی با کرمهای قلابدار (کرمدرمانی)، زنبوردرمانی، انعکاسدرمانی و طب سوزنی است. بیشترین افرادی که از اینگونه درمانها استفاده میکنند، عبارتند از: بیماران زن، کسانی که در اثر ابتلای طولانیمدت به اماس دچار ناتوانی و معلولیت شدهاند و کسانی که از درمانهای مرسوم پزشکی رضایتمندی کمتری دارند.
برای مطالعهٔ بیشتر
- The Royal College of Physicians (2004). Multiple Sclerosis. National clinical guideline for diagnosis and management in primary and secondary care. Salisbury, Wiltshire: Sarum ColourView Group. ISBN 978-1-86016-182-7. Free full text. Retrieved on 2007-10-01.
- Multiple sclerosis. Understanding NICE guidance. Information for people with multiple sclerosis, their families and carers, and the public. London: National Institute of Clinical Excellence. 2003. ISBN 978-1-84257-445-4. Free full text (2003-11-26). Retrieved on 2007-10-25.
| در ویکیانبار پروندههایی دربارهٔ مدیریت بیماری اماس موجود است. |
| نشانگان و علامات | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| بررسی و تشخیص | |||||||||
| درمانهای تأیید شده | |||||||||
| درمانهای دیگر | |||||||||
| بیماریهای میلینزدا |
|
||||||||
| سایرین | |||||||||