پادتن مونوکلونال
پادتنهای تَکتیره یا آنتیبادی مونوکلونال (به انگلیسی: Monoclonal antibodies) به اختصار mAb یا moAb، پادتنهایی تکگونه و همانند یکدیگر هستند. علت این همانندی این است که پادتنها مونوکلونال توسط نوعی سلول ایمنی همانندسازیشده از یک سلول والد تولید میشوند. البته معمولاً با تکثیر ریکامبیننت این پادتنها ساخته میشوند.
آنتیبادیهای مونوکلونال ممکن است میل ترکیبی تک ظرفیتی داشته باشند و فقط به همان اپیتوپ (بخشی از آنتیژن که توسط آنتیبادی شناسایی میشود) متصل شوند. در مقابل، آنتیبادیهای پلی کلونال به اپی توپهای متعدد متصل میشوند و معمولاً توسط چندین نوعِ مختلف سلولهای پلاسما ترشح کننده آنتیبادی ساخته میشوند. آنتیبادیهای مونوکلونال دو گونه ای را نیز میتوان برای اهداف درمانی، به یک آنتیبادی مونوکلونالِ دو اپیتوپی تولید کرد.
تقریباً برای همه نوع مادهای میتوان پادتن تکتیره ساخت که به آن اتصال یابد و برای شناسایی یا پاکسازی آن، استفاده کرد. این توانایی به ابزار مهمی در زیستشیمی، زیستشناسی مولکولی و پزشکی تبدیل گشتهاست. آنتیبادیهای مونوکلونال در سطح بالینی برای تشخیص و هم برای درمان چندین بیماری استفاده میشوند. تجویز آنتیبادیهای مونوکلونال توسط چندین کشور برای درمان علائم متوسط COVID-19، مجاز در نظر گرفته شدهاست.
نحوه تولید پادتنهای تکتیره
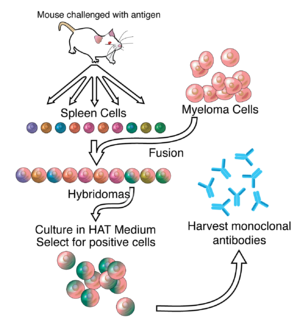
در محیط کشت خارج از بدن بهطور طبیعی لنفوسیتهای B (تولیدکننده پادتنها) طی چند هفته میمیرند. به همین علت این لنفوسیتها با سلولهایپ توموری که سلولهای میلوم نام دارند، ادغام میشوند. سلولهای میلوم مانند بقیه سلولهای سرطانی قادر هستند، به صورت نامحدود تقسیم شوند و به «سلولهای نامیرا» معروف گردند. این رده سلولی نامیرا که ادغامی از لنفوسیت B و سلولهای میلوم هستند، یک رده سلولی هیبریدی را تشکیل میدهند که خصوصیات هر دو سلول ادغام شده را داراست. هیبریدی قادر هستند که خارج از بدن نیز به صورت نامحدود تکثیر و پادتن تولید کنند. برای اینکه پادتنهای تک تیره تولید شوند، باید یک حیوان با آنتیژن مورد نظر در تماس قرار گیرد و بدن جاندار شروع به ایمنسازی کند. در طی چند هفته متوالی سلولهای B اختصاصی آنتیژن شروع به تکثیر و ترشح پادتنهای اختصاصی میکنند. بافت طحال که مملو از لنفوسبتهای B است از موش استخراج شده و لنفوسیتهای B جدا شده با سلولهای میلوم ادغام میشوند. با وجودی که بسیاری از سلولها در محیط کشت قادر به ادغام شدن و تکثیر هستند، تنها میزان بسیار کمی ار آنها (سلولهای هیبریدی تولیدکننده پادتن) قادر به بقا هستند. روش تشخیص سلولهای هیبریدی از سلولهای دیگر به این صورت است که به محیط کشت هیپوکسانتین، آمینوپترین و تیمیدین(HAT) افزوده میشود. این محیط کشت اختصاصی از رشد سلولهای میلوم ادغام نشده جلوگیری میکند چرا که این سلولها قادر نیستند از هیپوکسانتین و تیمیدین به خاطر آمینوپترین که یک بلوککننده متابولیکی است، استفاده کنند. سلولهای میلوم یک نقص ژنتیکیای را حمل میکنند که پس از ادغام با سلولهای B به تعادل میرسند. سلولهای B ادغام نشده نیز پس از چند روز میمیرند به این دلیل که این سلولها در محیط کشت قادر به رشد و تکثیر نیستند. پس از ادغام سلولی باید سلولهای هیبریدی تولیدکننده پادتن شناسایی و استخراج شوند. تست ELISA برای شناسایی این سلولهای هیبریدی مورد استفاده قرار میگیرد. پس از شناسایی و استخراج این کلونهای سلولی میتوان آنها را به صورت in vivo به عنوان یک تومور تولیدکننده پادتن یا به صورت ex vivo در یک محیط کشت، کشت داد. پادتنها میتوانند از خون حیوان که دچار لوسمی شدهاست یا از محیط کشت جداسازی شوند.
کاربردهای درمانی
از پادتنهای تکتیره برای شناسایی یا پالایش مواد بهره میگیرند. امروزه پادتنهای تکتیره کاربردهای درمانی زیادی دارند مانند درمان بیماریهای خودایمنی (مانند مولتیپل اسکلروز)، مهار دستگاه ایمنی در هنگام پیوند عضو و درمان سرطان. مانند اینفیلیکسیماب، ادالیموماب و daclizumab در درمان التهاب؛ rituximab و gemtuzumab در درمان سرطان و داکلیزاماب در هنگام پیوند عضو.
اکتشاف
ایده «گلوله جادویی» ابتدا توسط پل ارلیش ارائه شد، که این دانشمند در ابتدای قرن بیستم ادعا کرد که اگر ترکیبی ساخته شود که بتواند بهطور اختصاصی به ارگانیسم ایجادکننده بیماری متصل شود، سپس میتوان این ماده را سوار بر یک توکسین نموده و به سمت آن ارگانیسم فرستاد. او و الی مچنیکوف به خاطر این کار علمی که درمان موفقیتآمیزی برای سیفلیس در سال ۱۹۱۰ ایجاد نمود، در سال ۱۹۰۸ موفق به دریافت جایزه نوبل پزشکی شدند.
در دهه ۱۹۷۰، سرطان مالتیپل میلومای سلول B شناخته شد، و کشف شد که سلولهای سرطانی B، همه از یک نوع پادتن تولید مینمایند (پاراپروتئین). این اکتشاف برای مطالعه ساختار پادتن مورد استفاده قرار گرفت اما هنوز تولید پادتنهای اختصاصی برای یک آنتیژن ممکن نبود.
تولید پادتن تکتیره که شامل سلولهای هیبرید موش-انسان بود در سال ۱۹۷۳ توسط جرالد شوابر بیان شد و بین افرادی که از هیبریدوماهای انسانی استفاده میکردند بهطور گسترده مورد بحث واقع شد، اما بحث بر اینکه چه کسی برای بار اول فرضیه را بیان کردهاست باقیماند. یک سند عملی تاریخی روی این موضوع اعتباری را برای شوابر جهت اختراع این تکنیک به همراه داشت که بهطور گسترده هم مورد بحث قرار گرفت ولی خیلی زود بیان شد که او تقلب کردهاست. این اختراع توسط کاتن و میل اشتاین و سپس کوهلر و میل اشتاین به عرصه عمل گذاشته شد. کوهلر، میل اشتاین و کاج یرن در سال ۱۹۸۴ جایزه نوبل پزشکی و فیزیولوژی را دریافت نمودند. ایده اصلی بر این قرار بود که سلولهای سرطانی میلوما که توانایی ترشح پادتن را از دست دادهاند، توسط یک تکنیک با سلولهای سالم B لقاح کرده و در نهایت نیز بتوان سلولهای لقاح کرده را جدا نمود. این ایده توسط میل اشتاین و کوهلر در تحقیقشان برای یافتن ابزاری جهت یافتن تنوع پادتنها به عمل درآمد.
در ۱۹۸۸، گِرگ وینتر و تیم او پیشگام این تکنیکها برای انسانی نمودن پادتنهای تکتیره شدند، و واکنشهایی را که پادتنهای تکتیره ایجاد مینمودند را از بین بردند.
تولید
سلولهای هیبریدوما
پادتنهای تکتیره معمولاً از سلولهای لقاح شده میلوما با طحال موش که توسط آنتیژن مورد نظر امیونیزه شدهاست، ساخته میشود. به هر حال پیشرفتهای اخیر سبب استفاده سلولهای B خرگوش برای تولید هیبریدومای خرگوش نیز گردیدهاست. پلی اتیلن گلیکول برای لقاح غشاهای پلاسمایی مجاور به هم استفاده میشده، اما حاصل این روش کم بوده بنابراین یک محیط انتخابی که فقط سلولهای لقاح شده بتوانند در آن رشد کنند مورد استفاده قرار میگیرد. این کار امکانپذیر است چون سلولهای میلوما توانایی سنتز هیپوزانتین گوانین فسفوریل ترانسفراز(HGPRT) را که برای سنتز رهاسازی اسیدهای نوکلئیک لازم است، از دست دادهاند. غیاب این آنزیم تا زمانی که مسیر سنتز پورین de novo از بین نرود برای این سلولها مشکلی ایجاد نمیکند. با قرار دادن سلولها در معرض آمینوپترین (یک آنالوگ فولیک اسید، که دهیدروفولات ردوکتاز را مهار میکندDHFR)، آنها دیگر نمیتوانند از مسیر de novo استفاده کرده و نسبت به اسیدهای نوکلئیک کاملاً اوکسوتروفیک میشوند که برای زنده ماندن نیاز به مکمل غذایی خواهند داشت.
این محیط انتخابی HAT نامیده میشود زیرا آن حاوی هیپوزانتین، آمینوپترین و تیمیدن است. این محیط برای سلولهای هیبریدوما انتخابی است. سلولهای میلومای لقاح نشده به دلیل فقدان HGPRT نمیتوانند رشد کنند، و بنابراین نمیتوانند DNA را همانند سازی نمایند. سلولهای لقاح نیافته به دلیل چرخه زندگی کوتاه خود نمیتوانند بهطور نامحدود زندگی کنند. فقط سلولهای هیبرید (هیبریدوما) در این محیط قادر به زندگی هستند چون سلول طحالی همراه آن HGPRT را تأمین کرده و سلول میلوما ویژگیهایی دارد که آن را نامیرا مینماید (مثل یک سلول سرطانی).
سپس مخلوط سلولها رقیق شده و کلونها از سلولهای تک والد روی چاهکهای میکروتیتر رشد میکنند. پس از آن پادتنهای ترشح شده با کلونهای مختلف از جهت تواناییشان برای اتصال به آنتیژن مورد بررسی قرار میگیرند (توسط روش ELISA یا آنتیژن میکروارای یا ایمونو دات بلات). سپس کارآمدترین و پایدارترین کلون برای استفاده مورد استفاده قرار میگیرد.
هیبریدوما میتواند بهطور نامحدود در محیط کشت مناسب رشد کند. حال سلول را میتوان به موش تزریق نمود (در حفره پریتوئن). آنجا، این سلولها ترشحی غنی از پادتن به نام آسیت ایجاد میکنند.
محیط کشت باید در طی انتخاب آزمایشگاهی غنی شود تا هیبریدوما بهطور ایدهآل رشد کند. این عمل را میتوان با استفاده از یک لایه سلول تغذیهکننده فیبروسیت یا محیط مغذی بریکلون (briclone) انجام داد. محیط کشت متعادل شده با ماکروفاژها نیز قابل استفادهاست. تولید در محیط کشت معمولاً بر تکنیک آسیت ترجیح داده میشود چون این روش برای حیوان دردناک است. هنگامی که روشهای دیگر در دسترس است روش آسیت غیراخلاقی تلقی میشود.
تخلیص پادتن تکتیره
بعد از به دست آوردن نمونه از محیط کشت سلولی یا نمونه مایع آسیت، پادتن مطلوب باید استخراج شود. آلودگیهای موجود در محیط کشت سلولی همان مواد موجود در آن شامل فاکتورهای رشد، هورمونها و ترانسفرینها هستند. بر خلاف آن، نمونههای آزمایشگاهی دارای پادتنهای میزبان، پروتئازها، نوکلئازها، نوکلئیک اسیدها، و ویروسها میباشند. در هر دو مورد، بقیه ترشحات سلولهای هیبریدوما مثل سیتوکاینها ممکن است وجود داشته باشند. همچنین آلودگی باکتریایی و وجود اندوتوکسین هم محتمل است. با توجه به پیچیدگی محیط کشت مورد نیاز در کشت سلول و بنابراین آلودگیهای آنها، یک روش باید نسبت به بقیه ترجیح داده شود(in vivo,in vitro).
نمونه در ابتدا برای تخلیص متعادل یا آمادهسازی میشود. سلولها، بقایای سلولی، چربیها و لختهها در ابتدا باید حذف شوند، که اصولاً پس از فیلتراسیون با فیلتر۰٫۴۵ میکرولیتر توسط سانتریفوژ صورت میگیرد. این ذرات بزرگ میتواند به عنوان پدیدهای به نام ترسیب غشا در مراحل بعدی تخلیص مطرح شود. به علاوه، غلظت محصول در نمونه ممکن است کافی نباشد، به خصوص در مواقعی که پادتن مورد نظر توسط سلولی با سطح ترشح پایین تولید شود. در این مورد نمونه باید با سانتریفوژ یا دیالیز تغلیظ شود.
اغلب ناخالصیهای باردار معمولاً آنیونهایی از جنس نوکلئیک اسیدها و اندوتوکسینها هستند. معمولاً آنها را با کروماتوگرافی تعویض یونی جدا میکنند. همچنین کروماتوگرافی تعویض کاتیونی، در pH پایین استفاده شده که پادتن مطلوب در ستون باقیمانده در حالی که آنیونها عبور میکنند یا آنیون کروماتوگرافی در pH بالا استفاده شده که پادتن مطلوب از ستون رد شده در حالی که آنیونها به ستون میچسبند. پروتئینهای مختلفی همراه آنیونها با توجه به نقطه ایزوالکتریکشان (pI) جدا میشوند. برای مثال، آلبومین pI برابر با ۴٫۸ دارد که بهطور عمدهای کمتر از پادتن تکتیرهاست که دارای pI برابر با ۶٫۱ میباشند. به عبارت دیگر، در یک pH، میانگین بار مولکولهای آلبومین بیشتر به سمت منفی سوق پیدا میکند. ترانسفرین، pI برابر با ۵٫۹ دارد بنابراین با این روش به راحتی نمیتواند جدا گردد. اختلاف pI حداقل باید ۱ باشد تا جداسازی بهطور مناسبی انجام شود.
ترانسفرین را میتوان با کروماتوگرافی حذفی با سایز جدا نمود. مزیت این روش در این است که آن یکی از قابل اعتمادترین روشهای کروماتوگرافی است. از آنجایی که کار ما با پروتئین هاست، ویژگیهایی مثل بار و توانایی اتصال ثابت نیستند و با توجه به pH مولکولی که دارای پروتون یا فاقد آن است متفاوت میباشند در حالی که اندازه تقریباً ثابت میماند. با این حال، این روش معایبی مثل تفکیکپذیری کم، ظرفیت کم و دفعات شستوشوی کم را دارد.
کمی سریعتر، روشی یک مرحلهای از جداسازی به نام کروماتوگرافی اتصال پروتئین A/G وجود دارد. پادتن بهطور انتخابی به پروتئین A/G متصل شده بنابراین خلوص بالایی (عموماً بالاتر از ۸۰٪) میدهد. به هر حال، این روش ممکن است برای پادتنهایی که به آسانی آسیب میبینند مشکل ساز باشد چون شرایط سختی در آن استفاده میشود. یک pH پایین میتواند با شکستن باند اتصال پادتن را از ستون جدا نماید. به علاوه تأثیر احتمالی بر محصول، pH پایین میتواند سبب نشت پروتئین A/G از ستون شده و آن را در نمونه شسته شده ظاهر کند. سیستمهای شستوشوی بافری ملایم که از غلظتهای بالای نمکی استفاده میکنند نیز برای جلوگیری از مواجهه پادتنها با pH پایین وجود دارند. هزینهها نیز یک مسئله مهم هستند چون رزین پروتئین A/G از رزینهای گرانقیمت است.
برای رسیدن به بیشترین خلوص در یک مرحله، تخلیص اتصالی را میتوان با استفاده از آنتیژن برای داشتن بیشترین اختصاصیت پادتن به کار برد. در این روش، آنتیژنی که برای جمعآوری پادتن استفاده میشود با پیوند کووالانسی به آگارز متصل شدهاست. اگر پادگن (آنتیژن) یک پپتید باشد، آن را معمولاً با یک سیستئین انتهایی سنتز میکنند، که اجازه اتصال به یک پروتئین حامل را میدهد، مثل KLH در حین پیشروی و حمایت برای تخلیص. سپس محیط حاوی پادتن با آنتیژن غیرمتحرک انکوبه شده، که به صورت کلی یا در هنگام عبور پادتن از ستون انجام میشود، که در آن بهطور انتخابی متصل گردیده و در حالی که ناخالصیها از ستون شسته میشوند میتوان آن را حفظ نمود. سپس شستوشو با بافر pH پایین یا بافر پرنمک برای حاصل کردن پادتن تخلیص شده مورد استفاده قرار میگیرد.
برای انتخاب بیشتر پادتنها، آنها را میتوان با استفاده از سدیم سولفات یا آمونیوم سولفات رسوب داد. پادتنها در غلظت پایین نمک رسوب میکنند در حالی که اکثر پروتئینها در غلظتهای بالاتر رسوب مینمایند. مقدار مناسب نمک اگر اضافه شود بهترین جداسازی حاصل میشود. میزان نمک اضافی سپس باید با روشی مثل دیالیز از محلول خارج شود.
خلوص نهایی را با استفاده از یک کروماتوگرام میتوان آنالیز کرد. هرگونه ناخالصی یک قله ایجاد میکند، و حجم زیر آن نشان دهنده مقدار آن است. به جای آن میتوان الکتروفورز ژل یا الکتروفورز مویینه را به کار برد. ناخالصیها سبب ایجاد باندهایی با شدتهای مختلف میشوند که به مقدار آن مربوط میشود.
عدم تجانس پادتن
عدم تجانس پادتن برای تکتیره پادتنها و سایر محصولات نوترکیب رایج است و معمولاً در حین بیان یا تولید نشان داده میشود.
این واریانتها معمولاً متراکم میشوند (محصولات دآمیداسیون، واریانتهای گلیکوزیلاسیون، زنجیرههای جانبی آمینواسید اکسید شده، همچنین اضافات آمینو و کربوکسیل انتهایی آمینو اسید). این تغییرات ظاهری لحظهای در ساختار یک تکتیره پادتن میتواند اثر عمیقی بر پایداری پیش بالینی و بهبودسازی فرایند داشته باشد همچنین در پتانسیل درمانی محصول، دسترسی زیستی و ایمنی. روش عمومی پذیرفته شده برای فرایند تخلیص پادتن تکتیره، شامل گیرانداختن پروتئین محصول مورد نظر با پروتئین A، شستوشو، اسیدیفیکاسیون برای غیرفعالسازی ویروسهای بالقوه پستانداران، کروماتوگرافی تعویض کاتیونی و کروماتوگرافی تعویض آنیون میباشد.
کروماتوگرافی جانشینسازی برای تشخیص و تعیین این واریانتهای نادیده در حجمهایی که برای تأیید در سیستمهای بعدی پیش بالینی مثل مطالعات فارماکوکینتیک حیوانی مناسب هستند، استفاده میشدهاست. دانش به دست آمده در حین گسترش فاز پیش بالینی برای فهم کامل کیفیت محصول ضروری است و یک پایه برای مدیریت ریسک و انعطافپذیری تنظیمی افزوده شده ایجاد میکند. ابتکار اخیر کیفیت توسط طراحی اتحادیههای غذا و دارو در تلاش است تا هدایتی در جهت توسعه ایجاد کرده و طراحی محصولات و فرایندهایی که کارایی و پروفایل ایمنی را افزایش میدهد به حداکثر رسانده درحالی که امکان تولید محصول را بالا میبرند.
نوترکیب
تولید پادتنهای تکتیره نوترکیب شامل فناوریهایی است که به نام کلونینگ جمعی یا نمایش فاژ/مخمر شناخته میشود. مهندسی پادتن نوترکیب شامل استفاده از ویروسها یا مخمر برای ساختن پادتنها است به جای استفاده از موش. این روشها به کلونینگ سریع قطعات ژن ایمونوگلوبولین برای ایجاد مجموعههایی از پادتنها با اختلافات ناچیز آمینواسیدی نسبت به پادتنهایی با اختصاصیتهای مطلوب که قابل انتخاب است، بستگی دارد. مجموعههای پادتن فاژ نوعی از مجموعههای آنتیژن فاژ هستند که توسط جورج پیژنیک اختراع شد. این تکنیکها میتواند برای بالابردن اختصاصیتی که پادتنها آنتیژنها، پایداریشان در شرایط محیطی مختلف، کارایی درمانی، و قابل جستجو بودن در کاربردهای تشخیصی را تشخیص دهند، استفاده شود. محفظههای تخمیر برای تولید این پادتنها در مقیاس بزرگ استفاده میشود.
پادتنهای کیمریک
به زودی متوجه شدند که مشکل اساسی برای کاربرد درمانی پادتنهای تکتیره روش ابتدایی است که پادتن موشی به جای انسانی ایجاد میکند. علیرغم تشابه ساختاری، اختلافات بین این دو برای ایجاد یک پاسخ ایمونولوژیک بعد از تزریق این پادتن به بدن انسان کافی بود، که در نهایت سبب حذف سریع آنها از خون به علت فعالیت سیستم التهابی و تولید پادتن ضد موش انسانی (HAMA) میگردید.
در تلاشی برای رفع این مانع، روشهایی برای استفاده از دی ان ای نوترکیب از سالهای ۱۹۸۰ به بعد کشف شد. در یکی از این روشها، DNA کدکننده بخش اتصالی پادتن تکتیره با DNA تولیدکننده پادتن در سلول انسانی زنده ادغام شد. بیان این DNA کیمریک از طریق کشت سلول پادتنهایی نیمه انسانی-موشی ایجاد نمود. برای این محصول، لغات توضیحی پادتن «کیمریک» و «انسانی» برای نشان دادن ترکیب منابع DNA انسان و موش در فرایندهای نوترکیبی مورد استفاده قرار گرفت.
پادتن کاملاً انسانی
از زمانی که فهمیده شد که میتوان پادتن تکتیره ایجاد نمود، دانشمندان برای جلوگیری از برخی اثرات جانبی پادتنهای انسانی شده یا کیمریک به دنبال ساخت پادتن کاملاً انسانی رفتند. دو روش موفق در این زمینه شناخته شد: موش ترانس ژنی و تظاهر فاژ.
موش ترانس ژنی تقریباً موفقترین روش برای ایجاد داروهای پادتن تکتیره کاملاً انسانی بودهاست: که ۷ تا از ۹ روش کنونی در بازار تجارت از این روش تبعیت میکند. موش ترانس ژنی توسط تعدادی از سازمانهای تجاری به بهرهبرداری رسیدهاست:
- Medarex — who marketed their UltiMab platform. Medarex were acquired in July 2009 by Bristol Myers Squibb[۱۸]
- Abgenix — who marketed their Xenomouse technology. Abgenix were acquired in April 2006 by Amgen.[۱۹]
- Regeneron's VelocImmune technology.[۲۰]
- Kymab - who market their Kymouse technology.[۲۱]
- Open Monoclonal Technology's OmniRat™ and OmniMouse™ platform.[۲۲]
یکی از موفقترین سازمانهای تجارتی که از تظاهر فاژ استفاده کردهاست Cambridge Antibody Technology (CAT) میباشد. دانشمندان CAT نشان دادند که تظاهر فاژ میتواند مورد استفاده باشد، بهطوریکه دامنههای متغیر پادتن میتواند روی پادتنهای فاژی رشتهای بیان شود.
سایر انتشارهای حائز اهمیت:
- Marks JD, Hoogenboom HR, Bonnert TP, McCafferty J, Griffiths AD, Winter G (دسامبر ۱۹۹۱). «By-passing immunization. Human antibodies from V-gene libraries displayed on phage". J. Mol. Biol. ۲۲۲ (۳): ۵۸۱–۵۹۷. doi:۱۰٫۱۰۱۶/۰۰۲۲–۲۸۳۶(۹۱)۹۰۴۹۸-U. PMID 1748994.
- Carmen S, Jermutus L (ژوئیه ۲۰۰۲). «Concepts in antibody phage display". Brief Funct Genomic Proteomic ۱ (۲): ۱۸۹–۲۰۳. doi:10.1093/bfgp/1.2.189. PMID 15239904.
کاربردها
آزمونهای تشخیصی
هرگاه پادتن تکتیرهای برای یک ماده مشخص ایجاد شود، میتوان به وسیله پادتن، حضور آن ماده را بررسی کرد. تستهای وسترن بلات و ایمونو دات بلات حضور پروتئین را روی یک غشا بررسی میکنند. آنها در ایمونوهیستوشیمی بسیار مفید هستند. این تستها آنتیژن ثابت شده روی قطعات بافتی را تشخیص میدهند و تست ایمونوفلورسانس ماده را در یک قطعه بافتی یخ زده یا سلول زنده تشخصی میدهند.
درمان دارویی
درمان سرطان
یک راه ممکن برای درمان سرطان استفاده از پادتن تکتیرهاست که فقط به آنتیژن اختصاصی سلول سرطانی متصل شده و یک پاسخ ایمونولوژیک علیه سلول سرطانی ایجاد میکند. این mAb همچنین برای ارسال یک توکسین، رادیوایزوتوپ، سیتوکاین یا کونژوگه فعال دیگری قابل استفاده میباشد. علاوه بر این این امکان وجود دارد که پادتنهایی با دو ویژگی تولید کرد که بتواند به وسیله ناحیه Fab به آنتیژن هدف و یک کونژوگه یا سلول اثرگذار متصل شود. در واقع، هر پادتن سالم میتواند به سلول گیرنده یا سایر پروتئینها به وسیله ناحیه Fc متصل شود.
بیماری خودایمن
پادتن تکتیره که برای این بیماریها استفاده میشود شامل اینفیلیکسیماب و ادالیموماب است که در پسوریازیس، آرتریت روماتوئید، بیماری کرون و کولیت اولسراتیو به وسیله تواناییشان در اتصال به و ممانعت از TNF آلفا است. Basiliximab و daclizumab IL-۲ را روی سلولهای T فعال غیرفعال میکند و درمان سبب ممانعت از رد پیوند کلیه خواهد شد.omalizumab Ige انسانی را غیرفعال کرده و در آسم ملایم تا شدید کاربرد دارد.
جستارهای وابسته
- <!Schwaber, J. ; Cohen, E. P. (۱۹۷۳). «Human x mouse somatic cell hybrid clone secreting immunoglobulins of both parental types". Nature ۲۴۴ (۵۴۱۶): ۴۴۴–۴۴۷. Bibcode:1973Natur.244..444S. doi:۱۰٫۱۰۳۸/۲۴۴۴۴۴a0. PMID 4200460. edit
- 2.Jump up ^ Science Citation Index
- 3.Jump up ^ Cambrosio, A. ; Keating, P. (۱۹۹۲). «Between fact and technique: the beginnings of hybridoma technology". Journal of the History of Biology ۲۵ (۲): ۱۷۵–۲۳۰. doi:10.1007/BF00162840. PMID 11623041. edit
- 4.Jump up ^ Köhler, G. ; Milstein, C. (۱۹۷۵). «Continuous cultures of fused cells secreting antibody of predefined specificity". Nature ۲۵۶ (۵۵۱۷): ۴۹۵–۴۹۷. Bibcode:1975Natur.256..495K. doi:۱۰٫۱۰۳۸/۲۵۶۴۹۵a0. PMID 1172191. edit
- 5.Jump up ^ The Story of César Milstein and Monoclonal Antibodies.
- 6.Jump up ^ Riechmann L, Clark M, Waldmann H, Winter G (مارس ۱۹۸۸). «Reshaping human antibodies for therapy". Nature ۳۳۲ (۶۱۶۲): ۳۲۳–۳۲۷. Bibcode:1988Natur.332..323R. doi:۱۰٫۱۰۳۸/۳۳۲۳۲۳a0. PMID 3127726.
- ۷.Jump up ^ Vlasek J, Ionescu R (۲۰۰۸). «Hetergeneity of Monoclonal Antibodies Revealed by Charge-Sensitive Methods". Current Pharmaceutical Biotechnology ۹ (۶): ۴۶۸–۴۸۱. doi:۱۰٫۲۱۷۴/۱۳۸۹۲۰۱۰۸۷۸۶۷۸۶۴۰۲. PMID 19075686.
- ۸.Jump up ^ Beck A, Wurch T, Bailly C, Corvaia N (مه ۲۰۱۰). «Strategies and challenges for the next generation of therapeutic antibodies". Nat. Rev. Immunol. ۱۰ (۵): ۳۴۵–۵۲. doi:10.1038/nri2747. PMID 20414207.
- ۹.Jump up ^ Khawli LA, Goswami S, Hutchinson R, et al. (۲۰۱۰). «Charge variants in IgG1: Isolation, characterization, in vitro binding properties and pharmacokinetics in rats". MAbs ۲ (۶): ۶۱۳–۲۴. doi:10.4161/mabs.2.6.13333. PMC 3011216. PMID 20818176.
- ۱۰.Jump up ^ Zhang T, Bourret J, Cano T (اوت ۲۰۱۱). «Isolation and characterization of therapeutic antibody charge variants using cation exchange displacement chromatography". J Chromatogr A ۱۲۱۸ (۳۱): ۵۰۷۹–۸۶. doi:10.1016/j.chroma.2011.05.061. PMID 21700290.
- ۱۱.Jump up ^ Rathore AS, Winkle H (ژانویه ۲۰۰۹). «Quality by design for biopharmaceuticals". Nat. Biotechnol. ۲۷ (۱): ۲۶–۳۴. doi:10.1038/nbt0109-26. PMID 19131992.
- ۱۲.Jump up ^ Siegel DL (۲۰۰۲). «Recombinant monoclonal antibody technology". Transfusion clinique et biologique: journal de la Société française de transfusion sanguine ۹ (۱): ۱۵–۲۲. doi:10.1016/S۱۲۴۶–۷۸۲۰(۰۱)۰۰۲۱۰–۵. PMID 11889896.
- ۱۳.Jump up ^ «Dr. George Pieczenik". LMB Alumni. MRC Laboratory of Molecular Biology (LMB). 17 September 2009.
- 14.Jump up ^ Schmitz U, Versmold A, Kaufmann P, Frank HG (۲۰۰۰). «Phage display: a molecular tool for the generation of antibodies—a review". Placenta 21 (Suppl A): S106–S112. doi:10.1053/plac.1999.0511. PMID 10831134.
- ۱۵.Jump up ^ Chadd HE, Chamow SM (آوریل ۲۰۰۱). «Therapeutic antibody expression technology". Curr. Opin. Biotechnol. ۱۲ (۲): ۱۸۸–۹۴. doi:10.1016/S۰۹۵۸–۱۶۶۹(۰۰)۰۰۱۹۸–۱. PMID 11287236.
- ۱۶.Jump up ^ Lonberg N, Huszar D (۱۹۹۵). «Human antibodies from transgenic mice". Int. Rev. Immunol. ۱۳ (۱): ۶۵–۹۳. doi:۱۰٫۳۱۰۹/۰۸۸۳۰۱۸۹۵۰۹۰۶۱۷۳۸. PMID 7494109.
- ۱۷.Jump up ^ http://en.wikipedia.org/wiki/Monoclonal_antibody_therapy
- 18.Jump up ^ «Bristol-Myers Buys Medarex Drugmaker for $۲٫۴ Billion (Update۳)».
- ۱۹.Jump up ^ «Amgen Completes Acquisition of Abgenix; Acquisition Provides Amgen with Full Ownership of Panitumumab and Eliminates a Denosumab Royalty".
- 20.Jump up ^ http://www.regeneron.com/velocimmune.html بایگانیشده در ۲۹ ژوئن ۲۰۰۹ توسط Wayback Machine
- 21.Jump up ^ «Proprietary antibody platform".
- 22.Jump up ^ «Naturally optimized human antibodies".
- 23.Jump up ^ McCafferty, J. ; Griffiths, A. ; Winter, G. ; Chiswell, D. (۱۹۹۰). «Phage antibodies: filamentous phage displaying antibody variable domains". Nature ۳۴۸ (۶۳۰۱): ۵۵۲–۵۵۴. Bibcode:1990Natur.348..552M. doi:۱۰٫۱۰۳۸/۳۴۸۵۵۲a0. PMID 2247164. edit
- 24.Jump up ^ Osbourn JK (۲۰۰۲). «Proximity-guided (ProxiMol) antibody selection". Methods Mol. Biol. 178: 201–5. PMID 11968489.
- ۲۵.Jump up ^ «Cambridge Antibody Technology".
- 26.Jump up ^ Osbourn JK, Derbyshire EJ, Vaughan TJ, Field AW, Johnson KS (ژانویه ۱۹۹۸). «Pathfinder selection: in situ isolation of novel antibodies". Immunotechnology ۳ (۴): ۲۹۳–۳۰۲. doi:10.1016/S۱۳۸۰–۲۹۳۳(۹۷)۱۰۰۰۷–۰. PMID 9530562.
- ۲۷.Jump up ^ «The Current State of Proteomic Technology".
- 28.Jump up ^ PhRMA Reports Identifies More than 400 Biotech Drugs in Development. Pharmaceutical Technology, August 24, 2006. Retrieved ۲۰۰۶-۰۹-۰۴.
- 29.Jump up ^ Modified from Carter P (نوامبر ۲۰۰۱). «Improving the efficacy of antibody-based cancer therapies". Nat. Rev. Cancer ۱ (۲): ۱۱۸–۲۹. doi:۱۰٫۱۰۳۸/۳۵۱۰۱۰۷۲. PMID 11905803.
- ۳۰.Jump up ^ Takimoto CH, Calvo E. «Principles of Oncologic Pharmacotherapy" in Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (Eds) Cancer Management
- ۳۱. ^ Jump up to: a b c d e f g h i j Rang, H. P. (2003). Pharmacology. Edinburgh: Churchill Livingstone. pp. 241, for the examples infliximab, basiliximab, abciximab, daclizumab, palivusamab, gemtuzumab, alemtuzumab and rituximab, and mechanism and mode. ISBN 0-443-07145-4
| لنفاوی |
|
||||||||
|---|---|---|---|---|---|---|---|---|---|
| لنفوسیتها | |||||||||
| مواد | |||||||||
|
داروهای مورد استفاده در پرتودرمانی (V10)
| |||||
|---|---|---|---|---|---|
| تسکیندهندههای درد | |||||
| آدرنرژیک تومورها | |||||
| پادتنهای CD20 | |||||
| ایزوتوپهای پرتوزا |
|
||||