استیک اسید
| استیک اسید | |||
|---|---|---|---|
| |||
| |||
|
اتانوئیک اسید | |||
|
دیگر نامها
استیل اسید اتیلیک اسید | |||
| شناساگرها | |||
| شماره ثبت سیایاس |
۶۴-۱۹-۷ |
||
| پابکم |
۱۷۶ |
||
| کماسپایدر |
۱۷۱ |
||
| UNII |
Q40Q9N063P |
||
| شمارهٔ ئیسی | 200-580-7 | ||
| شمارهٔ یواِن | 2789 | ||
| دراگبانک | DB03166 | ||
| KEGG |
C00033 |
||
| MeSH | Acetic+acid | ||
| ChEBI | CHEBI:15316 | ||
| ChEMBL |
CHEMBL۵۳۹ |
||
| IUPHAR ligand | 1058 | ||
| شمارهٔ آرتیئیسیاس | AF1225000 | ||
| کد اِیتیسی | G01AD02,S02AA10 | ||
| 506007 | |||
| 3DMet | B00009 | ||
| جیمول-تصاویر سه بعدی |
Image 1 Image 2 |
||
| |||
| |||
| خصوصیات | |||
| فرمول مولکولی | C2H4O۲ | ||
| جرم مولی | ۶۰٫۰۵ g mol−1 | ||
| شکل ظاهری | مایع بیرنگ | ||
| چگالی | 1.049 g/cm3 (l) 1.266 g/cm3 (s) |
||
| دمای ذوب | ۱۶٫۵ درجه سلسیوس (۶۱٫۷ درجه فارنهایت؛ ۲۸۹٫۶ کلوین) | ||
| دمای جوش | ۱۱۸٫۱ درجه سلسیوس (۲۴۴٫۶ درجه فارنهایت؛ ۳۹۱٫۲ کلوین) | ||
| انحلالپذیری در آب | قابل امتزاج به هر نسبت | ||
| اسیدی (pKa) | 4.76 | ||
| گرانروی | 1.22 mPa·s at 25 °C | ||
| ساختار | |||
| گشتاور دوقطبی | 1.74 D (گاز) | ||
| خطرات | |||
| طبقهبندی ئییو | مضر (Xn) خورنده (C) آتشگیر (F) |
||
| کدهای ایمنی | R۱۰, R۳۵ | ||
| شمارههای نگهداری | (S1/2), S۲۳, S26, S45 | ||
| لوزی آتش |

|
||
| نقطه اشتعال | |||
| LD50 | 3310 mg/kg, oral (rat) | ||
| ترکیبات مرتبط | |||
| مرتبط با کربوکسیلیک اسیدها |
فرمیک اسید پروپانوئیک اسید |
||
| ترکیبات مرتبط | استامید، اتیل استات، استیل کلرید، استیک انیدرید ، استالدهید، اتانول، تیواستیک اسید ، سدیم استات، پتاسیم استات | ||
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |||
| | |||
| Infobox references | |||
|
|
|||
اسید استیک یا نام آیوپاک آن اتانوئیک اسید، جوهر انگور یا جوهر سرکه جز اسیدهای آلی (از گروه کربوکسیلیک اسیدها) است. فرمول آن CH3COOH است.
نگاه کلی
اسید استیک جز اسیدهای کربوکسیلیک میباشد و در نامگذاری آیوپاک به اسید اتانوئیک معروف است. این اسید دارای فرمول شیمیایی میباشد و در قسمت چشایی طعم ترشی، شبیه طعم سرکه میدهد.
این اسید یک اسید ضعیف است، زیرا تنها مقداری اسید جدا شده در محلول آبی میباشد. استیک اسید بدون آب و خالص (استیک اسید یخی) یک مایع بدون رنگ بوده که آب را از محیط اطرافش جذب میکند (هیگروسکوپی) و در دمای ۱۶٫۵ درجه سانتیگراد (حدود ۶۲ درجه فارنهایت) به شکل یک جامد کریستالی بیرنگ منجمد میشود. اسید خالص و محلولهای غلیظ آن بسیار خورنده هستند.
استیک اسید یکی از سادهترین کربکسیلیک اسیدها است. این اسید یک معرف شیمیایی مهم بوده و یک ماده شیمیایی صنعتی مورد استفاده در تولید مواد زیر است: پلی اتیلن ترفتالات که به صورت عمده در بطریهای نوشابه استفاده میشود؛ سلولوز استات که بهطور عمده در فیلم عکاسی استفاده میشود؛ پلی وینیل استات برای چسب چوب به علاوه فایبرها و فابریکهای مصنوعی. در خانه، استیک اسید رقیق برای بازکردن لولهها استفاده میشود. در صنعت غذا، استیک اسید تحت کد افزودنی E260 به عنوان تنظیم اسیدینعت و به عنوان چاشنی استفاده میشود.
تقاضای جهانی استیک اسید در حدود ۶٫۵ میلیون تن (متریک تن در سال Mt/a) که حدود 1.5 Mt/a از طریق بازیافت برآورده میشود. باقی آن توسط بازار خوراک پتروشیمیایی یا منابع بیولوژیکی تولید میشود. استیک اسید رقیق تولید شده توسط تخمیر طبیعی، سرکه نامیده میشود.
باکتریهای مخمر سرکه به دلیل تمایل به تولید اسید استیک به این نام معروف شدهاند. این باکتریها در مواد غذایی، آب و خاک یافت میشوند. اسید استیک بهطور طبیعی از میوهها و برخی مواد غذایی فاسد شده از فرایند تخمیر تولید میشوند و از قدیمیترین ترکیبات شیمیایی شناخته شده توسط انسان میباشد.
نامگذاری
نام «اسید استیک» رایجترین و رسمیترین نامی است که توسط IUPAC برای این ماده بکار میرود. این نام از کلمه لاتین acetum، به معنی سرکه، گرفته شدهاست. «اسید اتانوئیک» که به عنوان مترادف آن بکار میرود، یک نام سازمانیافتهاست که گاهی در معرفی نامگذاری مواد شیمیایی عنوان میشود.
«اسید استیک منجمد» یک نام سطحی برای اسید استیک بدون آب است. مثل نام آلمانی Eisessig(که به صورت تحتاللفظی به معنای سرکه یخی است)، این نام، از نام کریستالهایی برگرفته شده که در دمای اندکی زیر ۷/۱۶ درجه سانتیگراد (حدود ۶۲ درجه فارنهایت) شکل میگیرند.
رایجترین و رسمیترین نام اختصاری برای اسید استیک AcOH یا HOAc است که در آن Ac مخفف گروه عاملی|گروه استیل است CH۳−C(=O)−؛ در واکنشهای اسیدی، علامت اختصاری HAc بکار میرود که در آن Ac مخفف استات آنیون (CH۳COO−) میباشد، هر چند که بسیاری این نامگذاری را گمراهکننده میدانند. باید توجه داشت که در حالتی دیگر نباید Ac را با مخفف عنصر شیمیایی اکتینیم اشتباه گرفت.
فرمول تجربی اسید استیک CH۲O و فرمول مولکولی آن C۲H۴O۲ است. حالت آخر با هدف نشان دادن بهتر ساختار، بهصورت CH۳-COOH, CH۳COOH، یا CH۳CO۲H نوشته میشود. یونی که در نتیجه حذف پروتون (H+) از اسید استیک به جا میماند «استات» آنیون نام دارد. همچنین نام «استات» به نمکی که حاوی این آنیون یا یک استر اسید استیک باشد اطلاق میگردد.
تاریخچه
قدمت سرکه به اندازه عمر تمدن و حتی بیشتر است. اسید استیکهای باکتریزا در همه جای جهان وجود دارند و هر فرهنگی که در آن عملآوری خمر همچون آبجو یا شراب وجود داشته، به ناچار سرکه را نیز که نتیجه طبیعی تماس این نوشیدنیهای الکلی با هوا بوده کشف کردهاند.
استفاده از اسید استیک در شیمی، به عهد باستان برمیگردد. در قرن سوم پیش از میلاد، تئوفراستوس فیلسوف یونانی تشریح کرد که سرکه چگونه بر روی فلزات اثر میکند تا از واکنش آنها رنگدانههای مورد استفاده در کارهای هنری تولید شوند که از آن جمله میتوان به «سرب سفید» (کربنات سرب) و «زنگار مس» اشاره کرد که ترکیبی سبز رنگ از نمکهای مس از جمله استات مس ۲ میباشد. رومیان باستان، شراب ترشیده را در ظرفهای سربی میجوشاندند تا از آن یک شربت بسیار شیرین با نام «ساپا» تهیه کنند. ساپا سرشار از استات سرب بود که به آن «شکر سرب» یا «شکر (افسانه) زحل» میگفتند و اشراف روم آن را در مسمومسازی با سرب بکار میگرفتند. در قرن هشتم، جابر بن حیان کیمیاگر ایرانی از طریق تقطیر اسید استیک را از سرکه جدا کرد.
در دوران رنسانس، اسید استیک منجمد از طریق تقطیر خشک استاتهای فلزی تهیه میشد. در قرن شانزدهم، آندریاس لیباویوس کیمیاگر آلمانی چنین رویهای را تشریح کرد و اسید استیک منجمد حاصل از این روش را با سرکه مقایسه کرد. وجود آب در سرکه بر ویژگیهای اسید استیک چنان تأثیر عمیقی داشت که شیمیدانها تا قرنها معتقد بودند که اسید استیک منجمد و اسیدی که در سرکه یافت میشود دو ماده مختلف هستند. پیر آدت شیمیدان فرانسوی ثابت کرد که این دو در حقیقت یکی هستند.
در سال ۱۸۴۷، هرمان کولب شیمیدان آلمانی برای اولین بار از طریق مواد معدنی موفق به ساخت اسید استیک شد. ترتیب این واکنش عبارت بود از کلردار کردن دی سولفید کربن و تبدیل آن به تترا کلراید کربن، سپس از طریق تفکافت به تتراکلرواتیلن و از طریق کلردار کردن آبی به اسید تری کلرواستیک و در نهایت کاهش آن از طریق برقکافت به اسید استیک.
تا سال ۱۹۱۰، اسید استیک منجمد اغلب از «تقطیر مشروبات الکلی» یا تقطیر چوب بهدست میآمد. با استفاده از هیدروکسید کلسیم را جدا میکردند؛ سپس استات کلسیم به جا مانده را با استفاده از اسید سولفوریک اسیدی میکردند تا از آن اسید استیک بهدست آید. در همین زمان، آلمان ۱۰٫۰۰۰ تن اسید استیک منجمد تولید میکرد که ۳۰درصد از آن برای تولید رنگ نیل استفاده میشد.
خواص شیمیایی
؛ قدرت اسیدی اتم هیدروژن (H) در گروه کربوکسیل (−COOH) در اسیدهای کربوکسیلیک همچون اسید استیک، میتواند به عنوان یک یون (پروتون) H+ آزاد شود و به آنها خاصیت اسیدی دهد. اسید استیک در محلولهای آبی یک اسید تکپروتونی مؤثر است با ارزش ثابت تفکیک اسیدی(pKa) آن   ۰/ ۱ A ۸/۴; pH مولاریته محلول آن (در حدود انسجام سرکه خانگی) ۴/۲ است که نشان میدهد ۴/۰ درصد از مولکولهای اسید استیک تفکیک یافتهاند.
ساختار کریستالی اسید استیک نشان میدهد که مولکولها به صورت دی مر جفت میشوند که پیوندهای هیدروژنی آنها را به هم متصل کردهاست. دیمرها را میتوان در بخار ۱۲۰درجه سانتیگراد شناسایی کرد. این حالت ممکن است در فاز مایع اسید استیک خالص نیز رخ دهد اما در صورت وجود آب، به سرعت به هم میریزد. سایر اسیدهای کربوکسیلیک پایینتر نیز این رفتار دیمرسازی را دارند.
حلال
اسید استیک مایع، مانند آب و اتانول یک حلال پروتوندار آبدوست (مولکول قطبی|قطبی) است. این ماده با ثابت دی الکتریک ۲/۶، میتواند علاوه بر حل کردن ترکیبات قطبی همچون نمکهای معدنی و شکرها، ترکیبات غیر قطبی همچون روغنها و عناصر شیمیایی مثل سولفور و آیودین را در خود حل کند. این ماده با بسیاری از حلالهای قطبی و غیر قطبی همچون آب، کلروفورم و هگزان مخلوط میشود. این خاصیت انحلال و امتزاجپذیری اسید استیک آن را به یک ماده شیمیایی پرکاربرد صنعتی تبدیل کردهاست. تمام
واکنشهای شیمیایی
اسید استیک برای بسیاری از فلزات از جمله آهن، منیزیم و روی خاصیت خورندگی دارد و در واکنش با آنها، گاز هیدروژن و نمکهای فلزی به نام استاتها تولید میکند. با قرار گرفتن آلومینیوم در معرض اکسیژن، یک لایه نازک از اکسید آلومینیوم بر روی سطح آن ایجاد میشود که نسبتاً مقاوم است. در نتیجه تانکرهای آلومینیومی در حملونقل اسید استیک مورد استفاده قرار میگیرند. استاتهای فلزی را میتوان از واکنش اسید استیک با یک باز نیز بهدست آورد؛ که نمونه مشهور آن واکنش «جوش شیرین = سرکه» میباشد. به جز استات کرومیم ۲، تقریباً کلیه استاتها در آب قابل حل هستند.
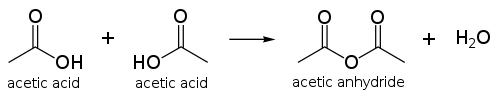
واکنشهای شیمیایی عادی یک اسد کربوکسیلیک در مورد اسید استیک اتفاق میافتد که تشکیل اتانول از طریق کاهش و تشکیل مشتقاتی همچون کلرید استیل از طریق استخلاف هستهدوست اسیل، از موارد قابل توجه آن هستند. دیگر مشتقات استخلافی عبارتند از آنیدریدهای استیک؛ این آنیدرید از طریق از دست دادن آب در دو مولکول اسید استیک رخ میدهد. به همین ترتیب، استرهای اسید استیک میتوانند از طریق استری کردن فیشری تشکیل شوند و آمیدها نیز به همین ترتیب بهوجود آیند. در صورتیکه اسید استیک در معرض حرارت بالای ۴۴۰ درجه سانتیگراد قرار گیرد، تجزیه شده و از آن دیاکسید کربن و متان یا کتن و آب تولید میشود.
شناسایی
اسید استیک را میتوان از طریق بوی خاص آن شناخت. یک واکنش رنگی برای نمکهای اسید استیک محلول کلرید آهن ۳ است که رنگ قرمز سیر ایجاد میکند که پس از اسیدیسازی ناپدید میشود استاتها وقتی با تریاکسید آرسنیک از اکسید کاکودیل حرارت داده میشوند، از طریق بوی بدی که تولید میکنند قابل شناسایی هستند.
بیوشیمی
گروه عامل|گروه استیل، که از اسید استیک مشتق شدهاند تقریباً در بیوشیمی کلیه گونههای حیات نقشی بنیادین دارند. آنها در مجاورت با کوآنزیم A به مهمترین قسمت متابولیسم کربوهیدراتها و چربیها تبدیل میشوند. در عین حال، به خاطر جلوگیری از برهم خوردن کنترل pH محتویات سلولی، تجمع اسید استیکهای آزاد در سلولها در سطوح پایین حفظ میشود. برخلاف اسیدهای کربوکسیلیک با زنجیره بلندتر (اسیدهای چرب)، اسید استیک در تری گلیسریدهای طبیعی بهوجود نمیآید. در عین حال، تری گلیسیرید مصنوعی تری استین (گلیسیرین تری استات) یک افزودنی غذایی متداول است و در مواد آرایشی و داروهای موضعی بکار گرفته میشوند.
اسید استیک توسط برخی میکروبهای گیاهی تولید و دفع|مدفوع میشوند که از مهمترین آنها میتوان به دسته «بچه سرکه» و کلوستریدیم استو بیتی لیکیوم اشاره کرد. این باکتریها در همه جا در مواد غذایی، آب و خاک یافت میشوند و با گندیدن میوهها و سایر غذاها، اسید استیک بهطور طبیعی تولید میشود. اسید استیک همچنین یکی از ترکیبات لیزکننده مهبلی آدمیزاد و سایر پستانداران نخستی است و در آنجا به عنوان یک عامل ضد باکتری ملایم عمل میکند.
تولید
اسید استیک، هم بهطور مصنوعی و هم از طریق تخمیر باکتریایی، تولید میشود. امروزه روش باکتریایی تنها ۱۰ درصد از تولید را به خود اختصاص دادهاست اما به دلیل اینکه قوانین جهانی مربوط به سلامت غذا بر تهیه سرکه خوراکی از مواد بیولوژیکی تأکید میکند، این روش همچنان برای تولید سرکه استفاده میشود. تقریباً حدود ۷۵ درصد از اسید استیک تولید شده برای استفادههای صنعتی، از کربندار کردن متانول و به روشی که در زیر میآید تولید میشود. برای بقیه مصارف، از روشهای دیگر استفاده میشود.
کل تولید جهانی اسید استیک ۵ میلیون تن در سال برآورد میشود که نیمی از آن در ایالات متحده تولید میشود. تولید این ماده در اروپا ۱ میلیون تن در سال است که میزان آن رو به کاهش نهاده؛ در ژاپن نیز تولید این ماده ۷/۰ میلیون تن در سال است. از سوی دیگر هر ساله ۵/۱ میلیون تن اسید استیک بازیافت میشود که تولید جهانی را به ۵/۶ میلیون تن در سال میرساند.
بزرگترین تولیدکنندگان اسید استیک دست نخورده، سلانس و بیپی|صنایع شیمیایی بی پی هستند. از دیگر تولیدکنندگان عمده این ماده میتوان به ملنیوم کمیکالز، استرلینگ کمیکالز، سام سونگ، ایستمن و سوونسک اتانول کمی اشاره کرد.
روشهای تولید صنعتی اسید استیک
کربونیلاسیون متانول: در این روش متانول با مونوکسید کربن در فشارهای بالا (۲۰۰atm) واکنش داده و اسید استیک تولید میکند. این روش از سال ۱۹۲۰ ابداع شدهاست و به دلیل ارزان بودن متانول و از لحاظ اقتصادی مقرون به صرفهاست.
اکسیداسیون بوتان: از حرارت دادن بوتان با اکسیژن هوا در حضور یونهای فلزی منگنز، کبالت و کروم، پراکسید تولید میشود. پراکسید در اثر تجزیه اسید استیک ایجاد میکند.
{۲C_4HiO + CO_۲ → ۴CH_3COOH + 2H_2O}
اکسیداسیون استالدئید: استالدئید در شرایط ملایم و در حضور کاتالیزورهای ساده فلزی مثل منگنز و کروم و… توسط اکسیژن هوا اکسید شده و اسید استیک تولید میکند.
{۲CH_3CHO + 2O_۲ → ۲CH_3COOH}
محصولات جانبی تولید شده در این واکنش مانند اسید فرمیک یا استات اتیل و… به دلیل داشتن نقطه جوش پایینتر از اسید استیک توسط تقطیر جداسازی میشوند. کاربرد اسید استیک به صورت سرکه به عنوان چاشنی غذا و تهیه انواع ترشی استفاده میشود. اسید استیک رقیق به عنوان افشانه برای از بین بردن قارچهای گیاهان استفاده میشود. اسید استیک گلاسیال در صنایع شیمیایی در تولید فیلمهای عکاسی، تولید پلاستیک پلیاتیلن تریفتالات (PET) استفاده میشود. همچنین به عنوان ماده واسطه در تولید استات وینیل که ترکیب مهمی در تولید چسب و رنگ میباشد،
کربندارکردن متانول
بیشتر اسید استیک جهان به روش کربندار کردن متانول تولید میشود. در این فرایند، متانول و مونو اکسید کربن با یکدیگر واکنش میدهند تا بر اساس معدله شیمیایی زیر اسید استیک تولید شود:
- متانول|CH۳OH+مونواکسید کربن |CO→ CH۳COOH
این فرایند که در آن یودو متان به عنوان میانجی مورد استفاده قرار میگیرد، در سه مرحله اتفاق میافتد. یک کاتالیزور که عمدتاً یک کمپلکس است برای کربندار کردن مورد استفاده نیاز است. (گام ۲)
- (۱)CH۳OH+ یودید هیدروژن|HI→یودومتان|CH۳I + H۲O
- (2) CH۳I + مونوکسید کربن |CO → CH۳COI
- (3) CH۳COI + H۲O → CH۳COOH + HI
با تغییر شرایط فرایند، میتوان در همان کارخانه آنیدرید استیک تولید کرد. از آنجا که هم متانول و هم مونواکسیدکربن مواد خام مناسبی هستند، کربندارکردن متانول از درباز به عنوان یکی از بهترین روشها برای تولید اسید استیک بهشمار میآمدهاست. در سال ۱۹۲۵، هنری درفیوس از سلانس بریتانیا یک کارخانه موازی کربندارکردن متانول را تأسیس کرد. با این حال نبود مواد کاربردی که بتوانند در فشارهای بالای مورد نیاز (۲۰۰ (واحد) اتمسفر یا بیشتر) حاوی مخلوطهای واکنشی خورنده باشند، باعث شد برای مدتی تمایل به تجاریسازی این روشها از بین برود.
اولین فرایند تجاری کربندارکردن متانول که در آن از کوبالت به عنوان کاتالیزور استفاده میشد، در سال ۱۹۶۳ توسط شرکت صنایع شیمیایی BASF انجام گرفت. در سال ۱۹۶۸، یک کاتالیزور رودیومی (cis−[Rh(CO)۲I۲]−) که میتوانست در فشارهای پایین بدون تولید هیچ فراورده جانبی عمل کند کشف شد. اولین کارخانهای که از این روش استفاده کرد، در سال ۱۹۷۰ توسط شرکت صنایع شیمیایی مونسانتو آمریکا ساخته شد و از آن پس، کربندارکردن متانول با کاتالیزور رودیومی به روش غالب در تولید اسید استیک تبدیل شد. (همچنین رجوع کنید به فرایند مونساتو). در اواخر دهه نود، شرکت صنایع شیمیایی بیپی استفاده تجاری از کاتالیزور کاتیوا ([Ir(CO)۲I۲]−) را که به وسیلهٔ روتنیم ارتقا یافته بود آغاز کرد. این فرایند که کاتالیزور آن ایریدیوم است طبیعتدوستتر و کارآمدتر است و تا حد زیادی جای فرایند مونسانتو را در همان کارخانه گرفتهاست.
اکسایش استالدئید
پیش از تجاری شدن روش مونسانتو، بیشتر اسید استیک از طریق اکسایش استالدئید تولید میشد. این روش به عنوان دومین روش مهم تولید پابرجا ماندهاست، هر چند که کربندارکردن متانول در آن، چندان مقرون به صرفه نیست. استالدئید را میتوان از طریق اکسایش بوتان یا نفتا یا آبدار کردن اتیلن بهدست آورد.
وقتی بوتان یا نفتای سبک در مجاورت یونهای مختلف فلزی از جمله یونهای منگنز، کوبالت، کرومیوم، پروکسید حرارت میبینند تجزیه میشوند تا براساس معادله شیمیایی زیر اسید استیک تولید کنند.
- ۲ بوتان|C۴H۱۰ + ۵ اکسیژن|O۲ → ۴ CH۳COOH + ۲ آب|H۲O
معمولاً، این واکنش در تلفیقی از حرارت و فشاری انجام میشود که در عین نگهداری بوتان در حالت مایع، دما را تا حد ممکن بالا نگه دارد. شرایط واکنشی معمولاً در دمای ۱۵۰ درجه سانتیگراد و فشار  ؛ اتمسفر ۵۵ قرار دارد. ممکن است در این میان چند فراورده جانبی نیز تولید شوند از جمله بوتانون، استات اتیل، اسید فورمیک و اسید پروپونیک. این فراوردههای جانبی از لحاظ تجاری با ارزش هستند و در صورتیکه از لحاظ اقتصادی مورد نیاز باشند، شرایط واکنش را تغییر می. دهند تا مقادیر بیشتری از این فراوردهها بهدست آید. در عین حال جداسازی اسید استیک از این فراوردههای جانبی ممکن است هزینههای فرایند را افزایش دهد.
تحت شرایط مشابه و با استفاده از کاتالیزورهای یکسان، همانگونه که در اکسایش بوتان صورت میگیرد، میتوان در هوا، استالدئید را برای تولید اسید استیک، توسط اکسیژن اکسید کرد.
- ۲ استالدئید|CH۳CHO + اکسیژن|O۲ → ۲ CH۳COOH
با استفاده از کاتالیزورهای جدید، میتوان از این واکنش بیش از ۹۵ درصد اسید استیک بهدست آورد. فراوردههای جانبی این واکنش عبارتند از استات اتیل، اسید فورمیک و فورمالدئید که همه آنها نسبت به اسید استیک نقطه جوش پایینتری داشته و به راحتی میتوان از طریق تقطیر آنها را جداسازی کرد.
اکسایش اتیلن
تخمیر
تخمیر اکسایشی
در بیشتر تاریخ بشری، اسید استیک در حالت سرکه، توسط گروه باکتریایی «بچه سرکه» ساخته میشدهاست. در صورت وجود اکسیژن کافی، این باکتری میتواند از انواع مختلف مواد غذایی الکلدار، سرکه تولید کند. شاخصترین این غذاها عبارتند از آب سیب، شراب و مخمر غلات|حبوبات، مالت، برنج، یا مالت سیبزمینی. کلیت واکنش شیمیاییای که توسط این باکتری تسهیل میشود عبارتست از
- اتانول|C۲H۵OH + اکسیژن|O۲ → CH۳COOH + آب|H۲O
محلول رقیق الکل که با «مخمر سرکه» آغشته شده باشد، در یک محیط گرم هوادار، طی چند ماه به سرکه تبدیل میشود. روشهای صنعتی تولید سرکه، با افزایش تأمین اکسیژن برای باکتری، این فرایند را تسریع میکنند.
احتمالاً اولین سرکهها، در پی اشتباه در فرایند شرابگیری تولید شدهاند. اگر فرایند تخمیر در حرارت بالا انجام گیرد، بچه سرکه بهطور طبیعی مخمر انگور را میپوشاند. با افزایش تقاضای سرکه برای مصارف آشپزی، پزشکی و بهداشتی، شرابفروشان خیلی سریع یادگرفتند تا چگونه در ماههای گرم پیش از آنکه انگورها برای تبدیل به شراب به اندازه کافی برسند، سایر مواد آلی را برای تولید سرکه مورد استفاده قرار دهند. از آنجا که شرابفروشان از چگونگی این فرایند آگاهی لازم را نداشتند، این روش کند و گاهی ناموفق بود.
یکی از اولین روشهای مدرن «روش سریع» یا «روش آلمانی» است که برای اولین بار در سال ۱۸۲۳ در آلمان بکار گرفته شد. در این فرایند، تخمیر در یک برج بستهبندی شده با تراشههای چوب یا زغال چوب صورت میگیرد. غذای الکلدار از بالای برج پاشیده میشود و اتمسفر زمین|هوای تازه یا بهطور طبیعی یا به صورت تبادل حرارت اجباری از پایین تأمین میشود. در این فرایند، تأمین بهتر هوا، زمان تهیه سرکه را از چند ماه به چند هفته کاهش میدهد.
امروزه بیشتر سرکهها در تانکرهای کشت میکروبیولوژیکی|کشت که در زیر آب غوطهور هستند تهیه میشوند. این روش برای اولین بار در سال ۱۹۴۹ توسط اوتو هروماتکا و هنریخ ابنر ابداع شد. در این روش، الکل در یک تانکر که بهطور مداوم محتویات آن به هم میخورد، به سرکه تخمیر میشود و اکسیژن نیز از طریق عبور حبابهای هوا از درون محلول تأمین میشود.
تخمیر بدون اکسیژن
برخی گونههای باکتریهای بیهوازی از جمله چندین نوع از دسته «کلاستریدیوم» قادرند بهطور مستقیم و بدون استفاده از اتانول به عنوان میانجی، شکرها را به اسید استیک تبدیل کنند. کلیت واکنش شیمیایی که توسط این باکتری انجام میشود عبارتست از:
- گلوکز|C۶H۱۲O۶ → ۳ CH۳COOH
جالبتر اینکه، از نظر شیمیدانان صنعتی، این باکتریهای بیهوازی| بیهوازیها میتوانند اسید استیک را از ترکیبات تک کربنی نظیر متانول، مونواکسیدکربن یا مخلوط دیاکسید کربن و هیدروژن تولید کنند:
- ۲دیاکسید کربن |CO۲+۴هیدروژن|H۲→ CH۳COOH + ۲ آب|H۲O
توانایی «کلوستریدیوم» در بهکارگیری مستقیم شکر، یا تولید اسید استیک از مواد کم هزینهتر بدین معناست که این نوع از باکتری بهطور بالقوه میتواند نسبت به اکسایندگان اتانول نظیر «بچه سرکه»، در تولید اسید استیک کارآمدتر باشد. با این حال، باکتری «کلاستریدیوم» نسبت به «بچه سرکه» در مقابل اسید مقاومت کمتری دارد. حتی در مقایسه با برخی انواع بچه سرکه که میتوانند با غلط ۲۰ درصدی اسید استیک سرکه تولید کنند، مقاومترین انواع «کلاستریدیوم» تنها میتوانند چند درصد اسید استیک در سرکه تولید کنند. در حال حاضر برای تولید سرکه، استفاده از «بچه سرکه» نسبت به استفاده از «کلاستریدیوم» و سپس تغلیظ آن، مقرون به صرفهتر است. در نتیجه با وجودی که باکتریهای استوژنیک از سال ۱۹۴۰ کشف شدهاند استفاده صنعتی از آنها به تعدادی کاربرد بیخطر محدود شدهاست.
کاربردها
تولید بسیاری از بسیاری از ترکیبات شیمیایی، اسید استیک به عنوان یک واکنشگر شیمیایی به کار میآید. مهمترین کاربرد خاص اسید استیک در تولید استات وینیل تکپاره است، که بلافاصله پس از آن آنیدرید استیک و استر تولید میشود. میزان اسید استیک مورد استفاده در سرکه به نسبت اندک است.
استات وینیل تکپاره
کاربرد اصلی اسید استیک در تولید استات وینیل تکپاره (VAM) است. بین ۴۰ تا ۴۵ درصد از اسید استیک تولید شده در جهان، به مصرف این کاربرد میرسد. این واکنش که کاتالیزور آن پالادیوم است، اتیلن، اسید استیک و اکسیژن تولید میکند.
- ۲ H۳C-COOH + ۲ اتیلن|C۲H۴ + اکسیژن|O۲ → ۲ استات وینیل |H۳C-CO-O-CH=CH۲ + ۲ آب (مولکول)|H۲O
استات وینیل میتواند به استات پلی وینیل یا سایر پولیمرها، پولیمریزه شود که این مواد در رنگها و چسبها کاربرد دارند.
تولید استر
مهمترین استرهای اسید استیک در تولید جوهر و رنگ و پوشش استفاده میشوند. استرها شامل انیل استات و نرمال بوتیل استات و ایزو بوتیل استات و پروپیل استات میشوند. آنها معمولاً توسط واکنش کاتالیستی ار اسید استیک و الکل تولید میشوند.
بیشتر استرهای استات، از استالدهید با استفاده از واکنش تیشچنکو تولید میشود. علاوه بر این، استاتها اتر به عنوان حلال برای نیترو سلولز، لاک اکریلیک، لاک الکل زدن به جداکنندهها و لکههای چوب استفاده میشود. اول، مونومرهای گلیکول از اتیلن اکسید یا اکسید پروپیلن با الکل تولید میشوند، که سپس با اسید استیک استری میگردند. سه محصول عمده عبارتند از اتیلن گلیکول اتر استات (EEA)، اتیلن گلیکول مونو بوتیل اتر استات (EBA)، و پروپیلن گلیکول مونو متیل اتر استات، معمولتر به عنوان PGMEA در فرایند تولید نیمه هادی، جایی که آن را به عنوان مقاومت در برابر حلال مورد استفاده شناخته شدهاست. این مصرف حدود ۱۵٪ تا ۲۰٪ از اسید استیک در سراسر جهان را شامل میشود. اتر استاتها به عنوان مثال EEA، نشان داده شدهاست به عنوان عوامل مضر برای تولید مثل انسان است.
انیدرید استیک
محصول مایعسازی دو مولکول اسید استیکآنیدرید استیک است. تولید جهانی آنیدرید استیک اصلیترین کاربرد است که بین ۲۰ تا ۳۰ درصد از تولید اسید استیک در جهان را به مصرف خود میرساند. آنیدرید استیک را میتوان بهطور مستقیم از #کربندار کردن متانول|کربندار کردن متانول در مجاورت اسید تولید کرد و میتوان کارخانههای کاتیوا| فرایند کاتیوا را برای تولید آنیدرید تطبیق داد.
آنیدرید استیک، یک عامل قوی اسیددار کردن است. با داشتن چنین خاصیتی، کاربرد اصلی آن در تولید [ترموپلاستیک سلولزی است که به عنوان یک بافت مصنوعی در فیلم عکاسی بکار میرود. همچنین آنیدرید اسید در تولید آسپرین، هرویین و سایر ترکیبات به عنوان واکنشگر عمل میکند.
سرکه
در حالت سرکه و نیز در نمکسود کردن سایر سبزیجات، محلولهای اسید استیکی (معمولاً ۵ تا ۱۸ درصد اسید استیک، با درصدی که معمولاً بر حسب جرم محاسبه میشود) بهطور مستقیم به عنوان یک چاشنی مورد استفاده قرار میگیرند. سرکه خانگی اغلب رقیقتر است (۵ تا ۸ درصد اسید استیک)، ولی در نمکسود کردن غذاها برای مصارف تجاری، محلولهای غلیظ تری مورد استفاده قرار میگیرد. میزان اسید استیکی که در سطح جهانی برای تولید سرکه مورد استفاده قرار میگیرد زیاد نیست اما از دیر باز این ماده یکی از پرکاربردترین مواد در تولید سرکه بودهاست.
کاربرد به عنوان حلال
همانگونه که گفته شد اسید استیک# خواص شیمیایی|بالا، اسید استیک منجمد یک حلال پروتوندار قطبی بسیار عالی است. این ماده اغلب در تصفیه مواد آلی به عنوان حلال کریستالسازی مجدد بکار میرود. اسید استیک ذوب شده خالص در تولید اسید ترفتالیک که ماده خام پلی اتیلن ترفتالیک (PET)است، به عنوان حلال بکار میرود. اگر چه در حال حاضر این کاربرد ۵ تا ۱۰ درصد از اسید استیک تولید شده در جهان را مصرف میکند، با افزایش تولید PET انتظار میرود این کاربرد افزایش بیشتری پیدا کند.
در واکنشهایی همچون فریدل کرافتس# اکلیلدار کردن فریدل کرافتس| اکلیلدار کردن فریدل کرافتس که در آنها کربوکاتیون وجود دارد، اسید استیک به عنوان یک حلال بکار میرود. به عنوان مثال، یک مرحله از تولید تجاری کافور مصنوعی، شامل نوآرایی ونگر میروین کمفین به استات ایزوبورنیل است؛ در این حالت اسید استیک برای حفظ کربندار کردن واکنش نوآرایی|بازآراسته، هم به عنوان حلال و هم به عنوان یک هسته دوست عمل میکند. در هنگام کاهش|اکسایش یک گروه نیترو آریل به یک آنیلین با استفاده از پالادیوم کربنی، اسید استیک به عنوان حلال انتخابی استفاده میشود.
در شیمی تحلیلی، اسید استیک منجمد برای تخمین مواد قلیایی ضعیف همچون آمیدهای آلی بکار میرود. اسید استیک منجمد به عنوان باز (شیمی)| باز از آب هم ضعیفتر است در نتیجه در این میانجی، آمید به عنوان یک باز قوی عمل میکند. سپس با استفاده از یک محلول در اسید استیک منجمد با خاصیت اسیدی بسیار قوی همچون اسید پرکلورید، میتوان عیار آن را اندازه گرفت.
سایر کاربردها
محلولهای رقیق اسید استیک، همچنین به خاطر خاصیت اسیدی ملایم آنها، مورد استفاده قرار میگیرند. در محیط خانگی، استفاده در آبگونه اسیدی ظهور فیلم و برداشتن جرم شیر آب و کتری از نمونههای آن است. خاصیت اسیدی همچنین از طریق سلولهای نیش ستاره دریایی، در درمان نیش ستاره دریایی جعبهای استفاده میشود که این کار از آسیبهای جدی یا حتی مرگ جلوگیری میکند. این خاصیت همچنین در درمان افراد مبتلا به آماس گوش| عفونت گوش خارجی به کار می. رود. همچنین در سیلوی خوراک دام، برای جلوگیری از رشد باکتریها و قارچها، به صورت افشانه از اسید استیک استفاده میشود. محلولهای رقیق اسید استیک میتواند در آزمایشگاه بالینی برای تشخیص تعداد گلبولهای قرمز و سفید استفاده شوند. یکی دیگر از استفادههای بالینی برای lysing سلولهای قرمز خون است، که میتواند ترکیبات مهم دیگر در ادرار را در هنگام آزمایش میکروسکوپی شناسایی کند. اسیدیته آن همچنین برای درمان نیش عروس دریایی کاربرد دارد و اگر فوراً استفاده شود از جراحات حاد و حتی مرگ جلوگیری میکند؛ و برای درمان عفونت گوش خارجی استفاده میشود. در این روش، اسید استیک به صورت افشانه بر برای علوفه دام به عنوان نگهدارنده افشانده میشود، تا رشد باکتری و قارچ تضعیف شود. اسید استیک آبی همچنین به عنوان یک حذفکننده زگیل و گندمه استفاده میشود از اسید استیک چندین نمک آلی و غیر آلی تولید میشود، از جمله:
- استات سدیم__ در صنعت نساجی و نیز به عنوان نگهدارنده غذایی (E number|E۲۶۲).
- استات مس ۲__ به عنوان رنگدانه و قراچکش
- استات آلومینیوم و استات آهن ۲__ به عنوان ثابتکننده رنگ
- استات پلادیوم ۲__ به عنوان کاتالیزور در واکنشهای جفتساز، همچون واکنش هک
- استات نقره در حشره کشها
- کنترل و از بین بردن کنه واروا در زنبور عسل
اسید استیکهای جایگزین تولید شده عبارتند از:
- اسید مونوکلرواستیک. MCA، اسید دیکلرو استیک (به عنوان محصول فرعی) و تری کلرواستیک. MCA در تولید رنگ نیل استفاده میشود.
- اسید برومو استیک، که برای تولید واکنشگر برومو استات اتیل استری میشود.
- اسید تری فلوئورواستیک که در ترکیبات عالی، یک واکنشگر رایج است.
مقادیر اسید استیکی که در سایر کاربردها بکار میرود (بجز TPA)، ۵ تا ۱۰ درصد از اسید استیک مورد استفاده در سطح جهان را به خود اختصاص دادهاست. در عین حال، انتظار نمیرود این کاربردها به اندازه تولید TPA، رشد کند. یکی از کاربردهای این اسید در پزشکی است که این اسید، در مقابل برخی از مواد، خاصیت آنتی باکتریال دارد و میتواند مواد را ضدعفونی کند. این اسید در غربالگری سرطان رحم نیز استفاده میشود. سازمان بهداشت جهانی، این ماده در شمار داروهای ضروری دستهبندی کردهاست.
ایمنی
اسید استیک غلیظ خورندهاست و در نتیجه باید با احتیاط با آن کار کرد، زیرا باعث سوختگی، آسیبهای دائم چشمی و سوزش اعضای دارای مایعات مخاطی میشود. این تاولها و آبلهها ممکن است تا چند ساعت پس از در معرض قرار گرفتن پدیدار نشوند. به هنگام کار کردن با این ترکیبها باید از دستکشهای مقاوم از جنس پلاستیک نیتریل استفاده کرد چراکه استفاده از دستکشهای لاتکس از ایمنی لازم برخوردار نیست. اسید استیک غلیظ در شرایط آزمایشگاهی به سختی مشتعل میشود. با بالا رفتن دما از مرز ۳۹ درجه سانتیگراد، ریسک تبدیل شدن آن به یک ماده منفجره در مجاورت هوا افزایش مییابد. (حد انفجار: ۴/۵ درصد تا ۱۶ درصد).
خطر محلولهای اسید استیک به میزان غلظت آن بستگی دارد. محلولهایی که اسید استیک آنها بیش از ۲۵ درصد است، به خاطر بوی زننده و بخار خورنده آنها در هود بخار نگهداری میشود. اسید استیک رقیق به شکل سرکه بیضرر است. با این حال وارد کردن محلولهای قویتر در آن، برای انسان و حیوانات ضرر دارد. این محلول به سیستم گوارش آسیب زده و تغییری مهلک را در خاصیت اسیدی خون ایجاد میکند.
به دلیل عدم تطبیق آن، پیشنهاد میشود که اسید استیک را از اسید کرومیک و اتیلن گلایکول و اسید نیتریک و اسید پرکلریک و پرمنگناتها و پر اکسیدها و هیدروکسیلها دور نگه دارید.
جستارهای وابسته
- سرکه
- نمکسود کردن، روشی برای نگهداری غذا
- باکتری اسید استیک، تولید سرکه از محلولهای الکلی
- اسید استیک (صفحه دادهها)
- بچه سرکه، یک دسته مهم از باکتریهای اسید استیک
- عامل پوستهزدایی، اغلب حاوی اسید استیک
؛ شیمی
- مواد شیمیایی معمولی، محل خرید مواد شیمیایی مورد استفاده در آزمایشها
- اسید کربوکسیلیک، هستند-COOH ترکیباتی که حاوی گروه
- اسید چرب، زنجیره مستقیم اسید کربوکسیلیک * استات آنیون، CH۳COO−، بطر خلاصه ‘’AcO−’’
- گروه استیل، گروه CH۳-CO–، بهطور خلاصه Ac
- کوآنزیم استیلA، یک حامل مهم استیل در سلولها
؛ مواد شیمیایی مرتبط
- اسید فورمیک، اسید کربوکسیلیک با یک اتم کربن کمتر به ازای هر مولکول
- اسید پروپیونیک، اسید کربوکسیلیک با یک اتم کربن بیشتر به ازای هر مولکول
- اتانول، اتیل الکل
- استالدئید
- استیک آنیدرید
- استات اتیل، یک حلال مهم
- اسید مونو کلرو استیک
- اسیدهای کلرواستیک
پیوند به بیرون
- Computational Chemistry Wiki
- Acetic acid MSDS (Material Safety Data Sheet)
- National Pollutant Inventory - Acetic acid fact sheet
- NIOSH Pocket Guide to Chemical Hazards
- ۲۹ CFR 1910.1000, Table Z-۱ (US Permissible exposure limits)
- Occupational Training NFPA tables
- Celanese, major acetic acid producer بایگانیشده در ۲۰۰۶-۱۰-۱۶ توسط Wayback Machine
- Usage of acetic acid in Organic Syntheses
- Acetic acid pH and titration - freeware for data analysis, simulation and distribution diagram generation
- اسید استیک _ acetic acid بازرگانی آسمان تجارت
پانویس
| مولکولها |
|
|||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
دوتریوم مولکولها |
||||||||||||||||||||
| اثبات نشده | ||||||||||||||||||||
| وابسته |
|
|||||||||||||||||||
|
پیرازولونها / پیرازولیدینها |
|
|---|---|
| سالیسیلاتها | |
| مشتقات استیک اسید و ترکیبات مرتبط |
|
| اوکسیکامها | |
| مشتقات پروپانوئیک اسید (پروفنها) |
|
|
N-آریلآنترانیلیک اسیدها (فنامیک اسیدها) |
|
| کوکسیب | |
| دیگر موارد | |
| ترکیبی | |
Items listed in bold indicate initially developed compounds of specific groups. #WHO-EM †Withdrawn drugs. ‡Veterinary use medications. | |
| داروهای ضدالتهاب غیراستروئیدی |
|
||||||
|---|---|---|---|---|---|---|---|
| مشتقات کپسایسین | |||||||
| متفرقه | |||||||