ومورافنیب
 | |
 | |
| دادههای بالینی | |
|---|---|
| تلفظ | /ˌvɛməˈræfənɪb/ VEM-ə-RAF-ə-nib |
| نامهای تجاری | Zelboraf |
| نامهای دیگر | PLX4032, RG7204, RO5185426 |
| AHFS/Drugs.com | monograph |
| مدلاین پلاس | a612009 |
| دادهها | |
| ردهبندی داروهای بارداری |
|
| روش مصرف دارو | خوراکی (قرص) |
| کد ATC | |
| وضعیت قانونی | |
| وضعیت قانونی |
|
| شناسهها | |
| |
| شمارهٔ سیایاس | |
| پابکم CID | |
| IUPHAR/BPS | |
| دراگبنک | |
| کماسپایدر |
|
| UNII | |
| KEGG |
|
| ChEMBL | |
| لیگاند بانک داده پروتئین | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.287.801 |
| دادههای فیزیکی و شیمیایی | |
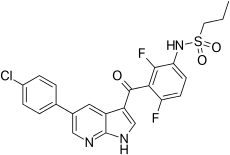
| فرمول شیمیایی | C23H18ClF2N3O3S۱ |
| جرم مولی | 489.92 g/mol g·mol−1 |
| مدل سه بعدی (جیمول) | |
| |
| |
| (verify) | |
| ومورافنیب | |
|---|---|
| مکانیسم دارویی | |
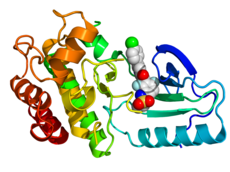 ساختار B-Raf با استفاده از روش بلورشناسی پرتو ایکس (N-ترمینال = آبی، C-ترمینال = قرمز) در ترکیب با «ومورافنیب» (کُرهها، کربن = سفید، اکسیژن = قرمز، نیتروژن = آبی، کلورین = سبز، فلئورین = آبی دریایی، سولفور = زرد).
| |
| موارد استفاده | ملانوما |
| هدف بیولوژیک | BRAF |
| مکانیسم عمل | مهارکننده پروتئین کیناز |
| پیوند به بیرون | |
| کد ایتیسی | L01XE15 |
| شناسهٔ لیگاند در PDB | ۰۳۲: PDBe, RCSB PDB |
| لیگپلات | 3og7 |
ومورافنیب (انگلیسی: Vemurafenib) با نام تجاری «Zelboraf» یک داروی بازدارنده آنزیمی «BRAF» است که برای درمان ملانوما بکار میرود.
این دارو را ابتدا سازمان غذا و دارو آمریکا در تاریخ ۱۷ اوت ۲۰۱۱ جهت درمان مراحل پیشرفتهٔ ملانوما مورد پذیرش قرار دارد. سپس وزارت بهداشت کانادا در ۱۵ فوریه ۲۰۱۲ میلادی و کمیسیون اروپا در ۲۰ فوریه ۲۰۱۲ آن را تأیید کردند. کمیسیون اروپا این دارو را جهت مونوتراپی در بالغین مبتلا به ملانومای گسترشیافتهٔ غیرقابلجراحی که دارای جهش V600E باشند (تهاجمیترین نوع ملانوما) مورد پذیرش قرار دادهاست.
با بیشترین دوزِ قابل تحمل این دارو (یعنی ۹۶۰ میلیگرم، دو بار در روز)، حدود ۳۱٪ بیماران دچار ضایعات پوستی میشوند که نیازمند جراحی است. در پژوهشی دیگر، شایعترین عوارض جانبی این دارو عبارت بودن از: آرترالژی (۵۸٪)، راشهای پوستی (۵۲٪) و حساسیت به نور (۵۲٪).
این دارو در ترکیب با داروی ایپیلیموماب میتواند موجب بروز سمیت کبدی شود.
- مشارکتکنندگان ویکیپدیا. «Vemurafenib». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۳۰ نوامبر ۲۰۱۷.
