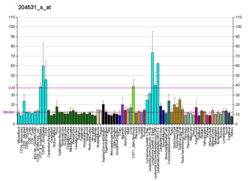
BRCA1
پروتئین ۱ مستعدکننده به سرطان پستان (انگلیسی: Breast cancer type 1 susceptibility protein) که بیشتر با نام اختصاری BRCA1 شناخته میشود (بخوانید: بِـرَکا وان؛ /ˌbrækəˈwʌn/) یک پروتئین و ژن است. اُرتولوگهای این پروتئین در سایر گونههای مهرهداران وجود دارد، اما ژنوم بیمهرگان، پروتئینهای دیگری با شباهت کمتر به BRCA1 را کدگذاری میکند. این ژن در انسان، یک ژن سرکوبگر تومور است (که به آن «ژن محافظ» هم میگویند) و کارش ترمیم دیانای است.
BRCA1 و BRCA2 پروتئینهایی مستقل و نامرتبط با هم هستند، اما هر دو در بافت پستان و برخی بافتهای دیگر بیان میشوند به ترمیم دیانای یا تخریب سلول در صورت عدم ترمیمپذیری دیانای کمک میکنند. این دو در ترمیم آسیبهای کروموزومی دخالت داشته و نقش مهمی در بازسازیهایِ عاری از خطایِ شکستگیهای دورشتهای دیانای دارند. اگر این دو ژن خودشان در اثر جهش آسیب ببینند، دیانای آسیبدیده دیگر ترمیم نخواهد شد و این موضوع احتمال بروز سرطان پستان را افزایش میدهد. بههمین دلیل به این دو، «پروتئینهای مستعدکننده به سرطان پستان» یا «ژنهای مستعدکننده به سرطان پستان» میگویند. الل غالب ژن، عملکرد سرکوبگر تومور دارد، حال آنکه جهشهای تخریبزای ژن، سبب از دست رفتن این عملکردِ مهم آنها شده و در نتیجه، احتمال سرطان پستان افزایش مییابد.
BRCA1 در کنارِ سایرِ سرکوبگرهای تومور، حسگرهای آسیب دیانای و هدایتگرهای پیام سلولی، یک پروتئین بزرگ چندبخشی را به نام BASC میسازند (کمپلکس پایش و مراقبت از ژنوم مرتبط با BRCA1). پروتئین BRCA1 با آرانای پلیمراز II و از طریق ریشهٔ کربوکسیل خود با کمپلکسهای هیستون داستیلاز در ارتباط است. در نتیجه این پروتئین در رونویسی ژن و بازسازی دیانای دو رشتهای،یوبیکوتیندار شدن، تنظیم رونویسی ژنی و چند عمل دیگر نقش دارد.
حق امتیاز روشهای تشخیص احتمال جهش در BRCA1 و BRCA2 افراد در اختیار میریاد جنتیکس است.مدل کسبوکار این شرکت و نحوهٔ ارائه انحصاری این روشهای تشخیصی که از یک شرکت نوپا در سال ۱۹۹۴ آغاز و به یک شرکت سهامی عام با ۱۲۰۰ کارمند و ۵۰۰ میلیون دلار درآمد در سال ۲۰۱۲ انجامید، سبب بروز اختلاف نظرها و مناقشاتی دربارهٔ قیمت زیاد این تستهای آزمایشگاهی و عدم توانایی درگرفتن نظرهای ثانویه از سایر آزمایشگاههای تشخیصی شد و سرانجام به شکایت و طرح دعوی حقوقی در دادگاه منجر شد.
کشف
نخستین شواهد از وجود یک ژن کدکننده آنزیم ترمیم دیانای که در استعداد به سرطان پستان دخیل است، در سال ۱۹۹۰ در آزمایشگاههای پژوهشی مری کلر کینگ در دانشگاه یو.سی. برکلی بهدست آمد. چهار سال بعد، بهدنبال یک رقابت بینالمللی جهت کشف آن، این ژن توسط دانشمندان دانشگاه یوتا، مؤسسه ملی علوم بهداشت محیط و میریاد جنتیکس کلون شد.
مکان ژن
در انسان، ژن BRCA1 بر روی بازوی بلند کروموزوم ۱۷ در منطقهٔ ۲، نوار ۱، از جفتباز شمارهٔ ۴۱٬۱۹۶٬۳۱۲ تا جفتباز شمارهٔ ۴۱٬۲۷۷٬۵۰۰ قرار گرفتهاست.(نقشهٔ ژنی). اُرتولوگهای این ژن در مهرهداران نیز شناسایی شده و نقشه کامل ژنی آن در دسترس است.
ساختار پروتئین
پروتئین BRCA1 دارای دومِـینهای زیر است:
- انگشت روی، نوع C3HC4 (دومین انگشت رینگ)
- دومین ریشه کربوکسیل BRCA1 (دومین بیآرسیتی)
این پروتئین همچنین دارای توالی متمرکزکننده هستهای و موتیفهای ساختاری سیگنال خروج هستهای است.
پروتئین BRCA1 انسان، دارای ۴ دومین پروتئین است: دومین انگشت رینگ نوع C3HC4، دومِـین سرین BRCA1 و ۲ دومین بیآرسیتی. این دومِـینها در حدود ۲۷٪ پروتئین BRCA1 را کدگذاری میکنند. ۶ نوع ایزوفرم شناختهشدهٔ BRCA1 هم تا کنون یافت شدهاست.
پروتئینهای BRCA1 و BRCA2 هیچ ارتباطی به هم نداردند و هومولوگ یا پارالوگ یکدیگر نیستند.

دومِـین انگشت روی رینگ
دومین انگشت رینگ، نوعی انگشت روی است که در پپتیدهای یوکاریوتها یافت شده و در حدود ۴۰ تا ۶۰ اسید آمینه، درازا دارد و دارای ۸ ریشهٔ حفاظتشدهٔ اتصال به فلز، ۲ گروه چهارتایی از ریشههای سیستئین و هیستیدین است که با ۲ اتم روی پیوند کوردیناسیونی برقرار میکنند. این موتیف دارای یک صفحه بتا موازیِ متضادِ کوتاه، دو حلقهٔ متصلشونده به روی و یک مارپیچ آلفای مرکزی است. دومِـین انگشت رینگ با پروتئینهای دیگر از BARD1 (که آن هم دارای دومین انگشت رینگ است) تعامل پروتئین-پروتئین دارد و یک هترودیمر ایجاد میکند. در دو طرف دومین انگشت رینگ، مارپیچهای آلفایی قرار میگیرند که از ریشههای ۸ تا ۳۳ و ۸۱ تا ۹۶ پروتئین BRCA1 تشکیل شدهاند. این قسمت، با بخش هومولوگ خود در BARD1 تعامل برقرار میکند که این هم دارای دومین انگشت رینگ دارد و در دوطرفش مارپیچهای آلفایی قرار میگیرند که از ریشههای ۳۸ تا ۴۸ و ۱۰۱ تا ۱۱۶ پروتئین تشکیل شدهاند. سرانجام این چهار حلقه به هم پیوسته و یک رابط هترودیمریزاسیون را ایجاد میکنند و موجب ثبات بیشتر کمپلکس شیمیایی BRCA1-BARD1 میشوند. استحکام بیشتر این کمپلکس از طریق تعامل ریشههای جانبی و تعاملهای شیمیایی هیدروفوبیک صورت میپذیرد. تعامل میان BRCA1-BARD1 در اثر جابجاییهای آمینواسیدی تومورزا بههم میخورد و همین موضوع نشان میدهد که استحکام و ثبات این پیوندها در خاصیت سرکوبگری تومور این پروتئین اهمیت دارد.
دومین انگشت رینگ یکی از اجزای مهم یوبیکوتین لیگاز E3 است که فرایند یوبیکوتیندار شدن را کاتالیزه میکند. یوبیکوتین یک پروتئین تنظیمی کوچک است که در تمامی بافتهای بدن یافت میشود و کارش هدایت پروتئینها به بخشهای مختلف سلول است. پلیپپتیدهای BRCA1 و بهویژه «لیزین-۴۸ متصل به پلییوبیکوتین» در هستهٔ سلول در حال استراحت، پخششدهاست، اما به محض شروع همانندسازی دیانای در گروههای تحت کنترل، که مشتمل بر BRCA2 و BARD1 هم هست، تجمع مییابند. احتمال دارد پروتئین BARD1 در تشخیص و اتصال اهداف پروتئینی برای فرایند یوبیکوتیندار شدن مؤثر باشد. این ملکول با اتصال به پروتئینها و نشاندار کردنشان، آنها را برای تخریب علامتگذاری میکند. فرایند یوبیکوتیندار شدن با اتصال BRCA1 آغاز و با شلاتهشدن روی خاتمه مییابد.
دومین خوشهٔ سرینی
دومِـین خوشهٔ سرینی BRCA1 که با نام اختصاری SCD هم شناخته میشود، مابین اسیدهای آمینهٔ ۱۲۸۰ تا ۱۵۲۴ قرار دارد. بخشی از این دومِـین، در اگزونهای ۱۱ تا ۱۳ واقع شدهاست. نرخ جهش در اگزونهای ۱۱ تا ۱۳ بسیار زیاد است. جایگاههای گزارششده فسفریلاسیون BRCA1 بیشتر در منطقهٔ SCD بودهاست که بهصورت درونکشتگاهی و درونجانداری توسط ایتیام سریان/ترئونین کیناز فسفریله میشود. مادهٔ اخیر، آنزیم کینازی است که در اثر آسیب به دیانای فعال میشود. جهش در ریشههای سرینی سبب میگردد که BRCA1 نتواند محلهال آسیبدیده را شناسایی کند و فرایند بازسازی دیانای دچار اختلال شود.
دومِـین بیآرسیتی
دومین بیآرسیتی دوگانهٔ پروتئین BRCA1، ساختاری طویل، به درازای حدود ۷۰ آنگستروم و پهنای ۳۰ تا ۳۵ آنگستروم است. دومینهای ۸۵ تا ۹۵ آمینواسیدی در BRCT ممکن است به صورت ماژولهای منفرد یا تکرارهای متوالی حاوی دو دومِـین یافت شوند. هر دوی این ترکیببندیها را میتوان در یک پروتئین واحد در جریان صورتبندیهای گوناگون مولکول دید. حضور ریشهٔ کربوکسیل BRCT در پروتئین BRCT جهت بازسازی دیانای، تنظیم رونویسی و سرکوب تومور ضروری است. در مولکول BRCA1، توالی تکرارشوندهٔ دومینهای بیآرسیتی دوگانه، یک آرایش سهبعدی و از سر-تا-دُم دارند که یک رابط همکنشگر ۱۶۰۰ آنگسترومی هیدروفوبیک با قابلیت اتصال به حلالها را پنهان میکند و شکل دکمه-در-سوراخ جمعوجوری به این رابط میدهد. این دومِـینهای هومولوگ در کنترل فرایند بازسازی دیانای نقش دارند. وقوع جهش جهش بدمعنی در این رابط هر یک از این دو پروتئین ممکن است سبب آشفتگی و بههمخوردن چرخه سلول و افزایش احتمال بروز سرطان گردد.
مکانیسم و عملکرد
پروتئین BRCA1 بخشی از یک مولکول ترکیبی پیچیدهاست که کارش بازسازی دیانای است. رشتههای دوتایی دیانای بهطور مداوم در معرض آسیب و شکستگی هستند. برخی اوقات تنها یک رشته میشکند و گاهی هر دو رشته، بهطور همزمان آسیب میبیند. عوامل پیونددهنده متقاطع دیانای یکی از علل مهم آسیبهای کروموزومی و دیانای هستند. شکستگیهای دورشتهای یک رویداد میانمرحلهای است که پس از برداشتهشدن پیوند متقاطع رخ میدهد و در حقیقت، نوع خاصی از آنمی فانکونی به نام «گروه مکمل اس» در اثر جهش دو آللی ژن BRCA1 رخ میدهد. همانطور که اشاره شد پروتئین BRCA1 بخشی از یک مولکول ترکیبی پیچیدهاست که کارش بازسازی دیانای پس از آسیب به هر دو رشتهاست. وقتی چنین اتفاقی میافتد، مکانیسمهای ترمیم نمیدانند دقیقاً بهشکل باید توالی صحیح دیانای را مرمت کنند و برای این منظور چندین راهکار را پیش میگیرند. یکی از مکانیسمهایی که پروتئین BRCA1 از آن استفاده میکند، «ترمیم با استفاده از رشته همسان» نام دارد که طی آن، پروتئینهای ترمیمکننده از کروماتید خواهر سالم، بهعنوان الگویی برای چینش صحیح توالیهای دیانای بهره میگیرد.
در هستهٔ بسیاری از سلولهای سالم طبیعی، پروتئین BRCA1 در حین فرایند ترمیم شکستگیهای دیانای، با مولکول RAD51 تعامل پروتئین-پروتئین دارد. چنین آسیبهایی در اثر قرار گرفتن در معرض تابش اشعههای یونیزان طبیعی یا در هنگام تبادل مواد ژنتیکی در حین تقسیم میتوز (مثلاً در کراسینگاور) رخ میدهد. پروتئین BRCA2 هم که عملکردی مشابه پروتئین BRCA1 دارد، با مولکول RAD51 تعامل دارد.
پروتئین BRCA1 در نوع دیگری از ترمیم دیانای موسوم به «ترمیم جفتشدن ناجور رشتهها» هم نقش دارد. BRCA1 با مولکولهای MSH2 تعامل پروتئین-پروتئین دارد. پروتئین اخیر به همراه MSH6، PARP و چند پروتئین دیگر که در ترمیم تکرشتهای دیانای نقش دارند و سطحشان در تومورهای پستانداران که دچار نقص BRCA1 هستند، بالا میرود.
پروتئین حاوی والوسین (یا VCP که با نام p97 هم شناخته میشود) در جذب BRCA1 به مکانهای DNA آسیبدیده نقش دارد. پس از تابش اشعههای یونیزان، VCP به محلهای آسیب دیانای میآید و با همکاری آنزیم RNF8، سبب تجمع مولکولهای ترکیبی پیامرسان و آغاز فرایند ترمیم مؤثر دیانای دورشتهای آسیبدیده میگردد. BRCA1 با VCP تعامل پروتئین-پروتئین دارد. BRCA1 همچنین با مولکول c-Myc و چند پروتئین دیگر جهت حفظ ثبات ژنها تعامل و همکاری دارد.
پروتئین BRCA1 مستقیماً به دیانای میچسبد و میل ترکیبیاش به رشتههای شاخهدار دیانای بیشتر است. توانایی این پروتئین در اتصال به دیانای این امکان را به آن میدهد تا جلوی فعالیت نوکلئازی «کمپلکس امآران» و همچنین فعالیت آنزیم MRE11A را بگیرد. شاید بههمین دلیل است که BRCA1 فرایند ترمیم اتصال انتهاهای غیر همولوگ را ترمیم چندان دقیقی نیست، ارتقا داده و بهبود میبخشد. پروتئین BRCA1 همچنین به مولکول γ-H2AX (که H2AFX فسفردارشده در سِـرین شماره ۱۳۹ است) در محل ترمیم دیانای میپیوندد که این موضوع نشاندهنده نقش احتمالی آن در فراخوانی عوامل ترمیمکننده دیگر است.
فرمالدهید و استالدهید عوامل طبیعی پیوندهای متقاطع دیانای است که ترمیمشان نیازمند مداخلهٔ مسیرهای BRCA1 است.
چنین عملکردی در ترمیم دیانای بسیار مهم است. موشهایی که دارای جهشهای کارکردزُدا در هر دو آلل BRCA1 باشند، زنده نمیمانند و تا سال ۲۰۱۵، دو انسان که دچار چنین جهشی بودند، شناسایی شده بودند که هر دو دچار اختلالات مادرزادی و تکاملی و همچنین سرطان بودند. یکی از اینها، تنها به این دلیل به سن بزرگسالی رسید که یکی از جهشهای ژن BRCA1 در او، از نوع هایپومورفیک بود.
رونویسی
به نظر میرسید که طی فرایند خالصسازی، پروتئین BRCA1 به همراه «هولوآنزیم آرانای پلیمراز II» در عصارهٔ سلولهای سرطانی HeLa، در کنار هم بهدست میآیند و تصور میشد که شاید بخشی از این هولوآنزیم باشد. پژوهشهای بعدی، نتایجی کاملاً متضاد به این فرضیه را مطرح کرد و نشان داد که ترکیب شیمیایی اصلی دارای BRCA1 در سلولهای HeLa، در واقع یک ترکیب پیچیده شیمیایی حاوی SWI/SNF است. این مولکول اخیر یک ترکیب ترمیمکننده کروماتین است. پیوند مصنوعی پروتئین BRCA1 به کروماتین در آزمایشگاه، نشان داد که این عمل، هتروکروماتین را تجزیه میکند و برای چنین کاری، نیازی به دومِـین تعاملکننده با SWI/SNF نیست. پروتئین BRCA1 با بخش NELF-B (COBRA1) از مولکول ترکیبی NELF نیز تعامل دارد.
جهشها و خطر سرطان
تغییرات خاصی در ژن BRCA1 منجر به افزایش خطر ابتلا به سرطان پستان بهعنوان بخشی از سندرم سرطان پستان-تخمدان ارثی میشود. محققان صدها جهش در ژن BRCA1 را شناسایی کردهاند که بسیاری از آنها با افزایش خطر ابتلا به سرطان در ارتباط هستند. زنان با ژن غیرطبیعی BRCA1 یا BRCA2، تا سن ۸۰ سالگی، رد حدود ۸۰٪ در معرض خطر ابتلا به سرطان پستان هستند. افزایش خطر ابتلا به سرطان تخمدان در زنان با جهش BRCA1، حدود ۵۵٪ و در زنان با جهش BRCA2 در حدود ۲۵٪ است.
این جهشها میتوانند تغییراتی در یک یا تعداد کمی از جفتبازهای دیانای (عناصر سازنده دیانای) باشند که با انجام آزمایش پیسیآر و تعیین توالی زنجیرهٔ دیانای قابل شناسایی هستند.
در بعضی موارد، بخشهای زیادی از دیانای بازآرایی میشوند. این بخشهای بزرگ، که به آنها «بازآراییهای کلان» نیز گفته میشوند، میتوانند حذف یا مضاعف شدن یک یا چند اگزون در ژن باشند. روشهای رایج برای تشخیص جهشهای ژنی (تعیین توالی) قادر به آشکار کردن این نوع جهش نیستند. روشهای دیگری نیز پیشنهاد شدهاست: پیسیآر کَمی سنتی، روش MLPA، و پیسیآر کَمی چندگانه از قطعات کوتاه فلورسنت. راهکارهای جدیدتر دیگری نیز اخیراً در دسترس است: تجزیه و تحلیل هترودوپلکس توسط الکتروفورز چند مویرگی یا آرایه اختصاصی الیگونوکلئوتیدها بر پایهٔ «هیبریداسیون مقایسهای ژنومی».
نتایج برخی از پژوهشها حاکی از آن است که متیلدار کردن پروموتر ژن BRCA1، که در برخی سرطانها گزارش شدهاست، میتواند به عنوان راهکاری برای غیرفعال کردن بیان ژن BRCA1 در نظر گرفته شود.
یک ژن جهش یافته BRCA1 معمولاً پروتئینی میسازد که به درستی کار نمیکند. پژوهشگران بر این باورند که پروتئین معیوب BRCA1 نمیتواند در رفع آسیب دیانای کمک کند که منجر به جهش در ژنهای دیگر نیز خواهد شد. تجمیع این جهشها ممکن است به سلولها اجازه رشد و تقسیم غیرقابل کنترل برای تشکیل تومور را بدهند؛ بنابراین، جهشهای غیرفعالکنندهٔ ژن BRCA1 احتمالاً منجر به افزایش خطر بروز سرطان میشود.
منطقهٔ 3' UTR در آرانای پیامرسان در این ژن، ممکن است توسط نوعی ریزآرانای احاطه و متصل شود که به آن «ریزآرانای میر-۱۷» میگویند. پژوهشگران معتقدند که تغییرات در ریزآرانای در کنار تغییرات «ریزآرانای میر-۳۰» ممکن است خطر سرطان پستان را افزایش دهد.
علاوه بر سرطان پستان، جهش در ژن BRCA1 خطر سرطان تخمدان و سرطان پروستات را افزایش میدهد. همچنین، ضایعات پیش سرطانی (که به آن دیسپلازی میگویند) در درون لوله رحم با جهشهای ژنی BRCA1 در ارتباط دارد. جهشهای بیماریزا در هر نقطه از یک مسیرهای ژنی که بهنحوی دربرگیرندهٔ BRCA1 و BRCA2 باشند، بهشدت خطر ابتلا به از سرطانهای خون و لنفوم را افزایش میدهد.
زنانی که ژن معیوب BRCA1 یا BRCA2 را به ارث بردهاند، در معرض خطر بسیار بالایی برای ابتلا به سرطان پستان و تخمدان قرار دارند. خطر ابتلا به سرطان پستان و / یا تخمدان آنچنان بالاست که برخی از این افراد ترجیح میدهند عملهای جراحی پیشگیری (برداشتن پستان و تخمدان) انجام دهند. حدس و گمان زیادی برای توضیح چنین اختصاصیت بافتی برای این ژنها وجود داشتهاست. عوامل اصلی تعیینکننده مکان بروز سرطانهای ارثی مرتبط با این دو ژن، با ویژگی بافتی پاتوژنهای سرطانزا، عوامل ایجادکنندهٔ التهاب مزمن یا مواد خاص سرطانزا در ارتباط است. بافت هدف ممکن است گیرندههایی برای پاتوژن داشته باشد، یا آنکه ممکن است بهطور انتخابی در معرض یک فرایند التهابی یا یک مادهٔ خاص سرطانزا قرار گیرد. نقص ذاتی ژنومی در یک ژن سرکوبگر تومور، پاسخهای ترمیمی-دفاعی طبیعی بدن را مختل کرده و حساسیت به بیماری را در اندام هدف تشدید میکند. این فرضیه همچنین متناسب با دادههای بهدست آمده دربارهٔ چندین سرکوبگر دیگر تومور، بهغیر از ژنهای BRCA1 یا BRCA2 است. یک مزیت عمده این فرضیه آن است که مطابق دادههای موجود، علاوه بر جراحیهای پیشگیری، گزینههای درمانی دیگری را نیز پیشنهاد میکند.
بیان کم BRCA1 در سرطانهای پستان و تخمدان
بیان ژن BRCA1 در اکثر موارد سرطانهای مجاری پستان با درجهٔ بدخیمی زیاد، کاهش یافته یا غیرقابل ردیابی است. مدتهاست پژوهشگران متوجه شدهاند که از دست رفتن فعالیت BRCA1، چه در اثر جهش در رگهٔ زایشی (مسیر تشکیل سلولهای زایا یا گامت) یا در اثر کاهش بیان ژن، منجر به تشکیل تومور در بافتهای خاص هدف میشود. بهطور خاص، کاهش بیان ژن BRCA1 به پیشرفت تومور پستان موردی یا ارثی کمک میکند. کاهش بیان این ژن، تومورزا است زیرا نقش مهمی در ترمیم آسیبهای DNA، به ویژه شکستگیهای دو رشتهای از مسیرهای ترمیمیِ عاری از خطا، نظیر «نوترکیبی همساخت» دارد. از آنجایی که سلولهایی که فاقد پروتئین BRCA1 هستند مجبورند از روشهای دیگری که خطای بیشتری دارد، استفاده کنند، کاهش یا غیرفعال شدن این پروتئین، سبب ایجاد جهش و بازآرایی کروموزومی فاحش میشود که ممکن است منجر به پیشرفت سرطان پستان گردد.
به همین ترتیب، بیان ژن BRCA1 در اکثر موارد (۵۵٪) سرطانهای تخمدان اپیتلیال غیر ارثی (EOC) کم است که رایجترین نوع سرطان تخمدان هستند و بیش از ۹۰٪ موارد سرطان تخمدان را تشکیل میدهند. در سرطان تخمدان سِـروزی که ۲/۳ موارد سرطانهای تخمدان اپیتلیالی را تشکیل میدهند، در نیمی از بیماران کاهش بیان ژن BRCA1 یافت میشود. پژوهشگری به نام بوتِـل، تمامی مقالات و پژوهشهایی را که به نقص ترمیم «نوترکیبی همساخت» و اثرش بر سرطانزایی اشاره داشتند، بررسی کرد. آنچه بیش از همه مورد توجه او واقع شد آن است که این نقص ژنی باعث ایجاد مجموعهای از وقایع سلولی-مولکولی میشود که ایجاد سرطان تخمدان سروزی با بدخیمی زیاد را در پی دارد و حتی میزان پاسخ آن را به درمان تعیین میکند. بهخصوص اشاره شد که کمبود پروتئین BRCA1 ممکن است دلیل بروز سرطان باشد؛ چه به دلیل جهش ژن BRCA1، یا هر گونه رویداد دیگری که موجب نقص یا کاهش بیان این ژن گردد.
جهش ژن BRCA1 در سرطان پستان و تخمدان
فقط حدود ۳٪ تا ۸٪ از کل زنان مبتلا به سرطان پستان دارای جهش در BRCA1 یا BRCA2 هستند. همچنین، جهشهای BRCA1 فقط در حدود ۱۸٪ از سرطانهای تخمدان دیده میشود [۱۳٪ جهش در رگهٔ زایشی (سلولهای جنسی) و ۵٪ جهش در سلولهای سوماتیک].
بنابراین، در حالی که بیان ژن BRCA1 در اکثر این سرطانها کم است، جهش BRCA1 بهتنهایی دلیل اصلی کاهش بیان ژنی نیست. برخی ویروسهای نهفته که به دفعات در تومورهای سرطان پستان شناسایی میشوند، میتوانند سبب کاهش بیان ژن BRCA1 و بروز تومورهای پستان شوند.
متیلدار شدن بیش از حدِ پروموتر BRCA1 در سرطان پستان و تخمدان
متیلدار شدن بیش از حدِ (هیپرمتیلاسیون) پروموتر BRCA1 فقط در ۱۳٪ از کارسینوماهای اولیه پستان تصادفاً انتخابشده وجود داشت. همچنین این پدیده فقط در ۵٪ تا ۱۵٪ موارد سرطانهای تخمدان اپیتلیال غیر ارثی یافت شد.
بنابراین، در حالی که بیان ژن BRCA1 در این سرطانها کم است، متیلاسیون پروموتر BRCA1 دلیل بسیار جزئی کاهش بیان است. (نه دلیل مهم و اصلی).
واپسرانی ریزآرانای BRCA1 در سرطانهای پستان
برخی ریزآرانای در صورت بیان بیش از حد، ساخت پروتئینهای ترمیمکننده دیانای خاصی را کاهش میدهند. در مورد سرطان پستان، «ریزآرانای-۱۸۲» (میر-۱۸۲) بهطور خاص ژن BRCA1 را هدف قرار میدهد. سرطانهای پستان را میتوان براساس وضعیت گیرنده یا بافتشناسی به ۴ دسته طبقهبندی کرد: سرطان پستان سهگانه-منفی (۱۵٪ - ۲۵٪ موارد)، سرطان پستان HER2+ (۱۵٪ - ۳۰٪ موارد)، سرطانهای ER+/PR+ (حدود ۷۰٪ موارد) سرطان) و کارسینوم لوبولار تهاجمی (حدود ۵٪ -۱۰٪ موارد سرطانهای مهاجم پستان). مشخص شدهاست که در هر چهار نوع سرطان پستان در مقایسه با بافت نرمال و طبیعی آن، سطح «ریزآرانای-۱۸۲» بهطور میانگین در حدود ۱۰۰ برابر افزایش دارد. در ردههای سلولی سرطان پستان، ارتباط معکوسی میان سطح پروتئین BRCA1 با بیان ژنی «ریزآرانای-۱۸۲» وجود دارد. بنابراین به نظر میرسد که دلیل اصلی کاهش یا فقدان پروتئین BRCA1 در سرطانهای مجاری پستان شدیداً بدخیم، ممکن است بیان بیش از حدِ «ریزآرانای-۱۸۲» باشد.
علاوه بر «ریزآرانای-۱۸۲»، یک جفت ریزآرانای تقریباً یکسان با نامهای «ریزآرانای-۱۴۶ای» و «ریزآرانای-۱۴۶بی-۱۵پی»، سبب کاهش بیان BRCA1 میشوند. این دو ریزآرانای در سرطان پستان سهگانه-منفی بیش از حد بیان میشوند که این واقعه، سبب غیرفعال شدن BRCA1 میشود.. بنابراین، «ریزآرانای-۱۴۶ای» و/یا «ریزآرانای-۱۴۶بی-۱۵پی» نیز ممکن است به کاهش بیان BRCA1 در این سرطانهای سهگانه-منفی کمک کنند.
واپسرانی ریزآرانای BRCA1 در سرطانهای تخمدان
در هر دو کارسینوم داخل اپیتلیالی لولهای سروزی [ضایعهٔ پیشساز سرطان تخمدان سروزی با بدخیمی زیاد(HG-SOC)] و در خودِ سرطان تخمدان سروزی با بدخیمی زیاد، بیان «ریزآرانای-۱۸۲» در حدود ۷۰٪ موارد افزایش قابل توجه دارد. در چنین سلولهایی که سطح «ریزآرانای-۱۸۲» در آنها بالاست، سطح پروتئین BRCA1 حتی پس از قرار گرفتن در معرض تابش اشعههای یونیزان کم میماند (واقعهای که بهطور طبیعی سبب افزایش بیان BRCA1 میشود). بنابراین ممکن است علت اصلی کاهش پروتئین BRCA1 یا فقدان آن، بیانِ بیش از حدِ «ریزآرانای-۱۸۲» باشد.
ریزآرانای دیگری که سبب کاهش بیان BRCA1 در سلولهای سرطانی تخمدان میشود، «ریزآرانای-۹» است. در میان ۵۸ بافت توموری بدستآمده از بیماران مبتلا به مرحله ۳ و ۴ سرطان تخمدان سروزی مهاجم (HG-SOG)، یک رابطه معکوس میان بیان «ریزآرانای-۹» و BRCA1 یافت شد؛ در نتیجه شاید افزایش «ریزآرانای-۹» در کاهش بیان ژن BRCA1 در این سرطانهای تخمدان دخیل باشد.
کمبود بیان BRCA1 احتمالاً سرطانزاست
به نظر میرسد آسیبدیدگی دیانای علت اصلی سرطان باشد و نقص در ترمیم این آسیبها، زمینهساز بسیاری از انواع سرطان است. اگر ترمیم دیانای دچار نقص باشد، آسیبدیدگیها کمکم تجمیع مییابند. جمع شدن و افزایش تدریجی این آسیبها ممکن است خطاهای جهشزا را در هنگام همانندسازی دیانای به سبب بازسازی دیانای - که مستعد خطاست - افزایش دهد. آسیب بیش از حد به دیانای همچنین ممکن است تغییرات اپیژنتیکی را به دلیل خطاهای حین ترمیم دیانای افزایش دهد. تمامی این وقایع، در نهایت احتمال ایجاد سرطان را افزایش میدهد. نقصهای مکرر در BRCA1 ناشی از ریزآرانای در سرطانهای پستان و تخمدان، احتمالاً به پیشرفت این سرطانها کمک میکند.
جهش در رگههای زایشی و اثر بنیانگذار
تمام جهشهای BRCA1 در رگههای زایشی (سلولهای جنسی) که تا به امروز شناسایی شدهاند، از نوع ارثی بودند که این موضوع ممکن است بهدلیل اثر بنیانگذار باشد که طی آن، جهش خاصی در یک گروه جمعیتی کاملاً مشخص، مشترک است و از نظر تئوری و ژنتیکی، میتوان آن را تا رسیدن به یک جد مشترک دنبال کرد. با توجه به پیچیدگیهای غربالگری جهش ژن BRCA1، این جهشهای رایج در یک جمعیت خاص، ممکن است روشهای مورد نیاز برای غربالگری جهشها را سادهتر کند. تجزیه و تحلیل جهشهایی که با احتمال و توالی بالا رخ میدهد، بررسی و مطالعه تظاهر بالینی آنها را نیز ممکن میسازد. نمونههایی از جلوههای اثر بنیانگذار در میان یهودیان اشکنازی دیده میشود. گزارش شدهاست که سه نوع جهش خاص در ژن BRCA1 در اغلب بیماران یهودی اشکنازی مبتلا به سرطان پستان یا تخمدان مرتبط با این ژن، دیده میشود: جهشهای 185delAG، 188del11 و 5382insC در ژن BRCA1. در حقیقت، ثابت شدهاست که اگر یک زن یهودی جهش بنیانگذار 185delAG و 5382insC را نداشته باشد، بسیار بعید است که جهش BRCA1 متفاوت دیگری پیدا کند. مثالهای دیگری از جهشهای بنیانگذار در BRCA1 در جدول ۱ آورده شدهاست (که عمدتاً از این منبع است).
| جمعیت یا زیرگروه | جهش BRCA1 | منابع |
|---|---|---|
| آمریکاییهای آفریقاییتبار | 943ins10, M1775R | |
| آفریقاییها | E881X, 1374delC | |
| یهودیان اشکنازی | 185delAG, 188del11, 5382insC | |
| اتریشیها | 2795delA, C61G, 5382insC, Q1806stop | |
| بلغاری | 2804delAA, IVS5+3A>G | |
| هلندی | Exon 2 deletion, exon 13 deletion, 2804delAA | |
| فنلاندی | 3745delT, IVS11-2A>G | |
| فرانسوی | 3600del11, G1710X | |
| کاناداییهای فرانسویتبار | C4446T | |
| آلمانی | 5382insC, 4184del4 | |
| یونانیها | 5382insC | |
| مجارها | 300T>G, 5382insC, 185delAG | |
| ایتالیاییها | 5083del19 | |
| ژاپنیها | L63X, Q934X | |
| بومیهای آمریکای شمالی | 1510insG, 1506A>G | |
| ایرلندیهای شمالی | 2800delAA | |
| نروژیها | 816delGT, 1135insA, 1675delA, 3347delAG | |
| پاکستانیها | 2080insA, 3889delAG, 4184del4, 4284delAG, IVS14-1A>G | |
| لهستانیها | 300T>G, 5382insC, C61G, 4153delA | |
| روسها | 5382insC, 4153delA | |
| اسکاتلندیها | 2800delAA | |
| اسپانیاییها | R71G | |
| سوئدیها | Q563X, 3171ins5, 1201del11, 2594delC |
باروری زنان
با افزایش سن در زنان، عملکرد باروری کاهش یافته و در نهایت به یائسگی میانجامد. این افت عملکردی با کاهش تعداد فولیکولهای تخمدان مرتبط است. اگرچه حدود ۱ میلیون اووسیت در بدو تولد در تخمدان انسان وجود دارد، اما تنها حدود ۵۰۰ (حدود ۰٫۰۵٪) از اینها به تخمکگذاری میرسند. به نظر میرسد کاهش ذخایر تخمدان با افزایش سن، با نرخی ثابت و مداوم در حال افزایش است و حوالی سن ۵۲ سالگی تقریباً تمامی ذخایر اووسیت مصرف شدهاند. با کاهش ذخیره تخمدانی و افت میزان باروری با افزایش سن، بهطور همگام، نارسایی بارداری و خطاهای تقسیم سلولی میوز افزایش مییابد که منجر به باروریهای دچار نقص کروموزومی میگردد.
به نظر میرسد زنانی که دچار جهش BRCA1 در سطح سلولهای رگههای زایشی هستند، نسبت به زنان دیگر دارای ذخیره کم اووسیتی و افت میزان باروری هستند. علاوه بر این، زنان با جهش BRCA1 ارثی دچار یائسگی زودرس میشوند. از آنجا که BRCA1 یک پروتئین اصلی و مهم ترمیمکننده دیانای است، این یافتهها نشان میدهد که آسیبهای دیانای طبیعی در اووسیتها در زنان دچار نقص BRCA1 با بازدهی کمتری ترمیم میشوند و این عدم کارایی ترمیم منجر به نارسایی زودرس باروری میگردد.
همانطور که پیشتر ذکر شد، پروتئین BRCA1 نقشی مهمی در ترمیم از نوع «نوترکیبی همساخت» ایفا میکند. این تنها فرایند ترمیمی شناخته شدهاست که میتواند شکافهای دو رشته دی انای را با دقت زیاد ترمیم کند. در انسان و موش، شکستگیهای دو رشتهای دیانای با افزایش سن در فولیکولهای بدوی تجمیع میشود. فولیکولهای بدوی، حاوی شامل اووسیتهایی هستند که در مرحله میانی (پروفاز ۱) میوز قرار دارند. میوز یک روند تقسیم سلولی در جانداران یوکاریوتی است که طی آن، سلولهای زایا تشکیل میشوند و احتمالاً نوعی تطابق تکاملی برای زدودن آسیبهای دیانای، به ویژه شکستگیهای دو رشتهای، از مسیر رگههای زایشی است. روش ترمیمی «نوترکیبی همساخت» با استفاده از BRCA1 خصوصاً در حین میوز افزایش مییابد. ثابت شدهاست که بیان چهار ژن اصلی ضروری برای روش ترمیمی «نوترکیبی همساخت» در شکستگیهای دو رشته دیانای (یعنی ژنهای BRCA1 و MRE11A و RAD51 و ایتیام سرین/ترئونین کیناز) با افزایش سن در اووسیتهای انسان و موش کاهش مییابد. در نتیجه این فرضیه مطرح میشود که ترمیم شکستگیهای دو رشتهای دیانای برای حفظ ذخیرهٔ اووسیتها ضروری است و کاهش کارایی ترمیم با افزایش سن، در پیری تخمدان نقش دارد.
شیمیدرمانی
سرطان ریه از نوع غیر سلولِ کوچک (NSCLC) مهمترین علت مرگومیر ناشی از سرطان در سراسر جهان است. در هنگام تشخیص، تقریباً ۷۰٪ از افراد مبتلا به NSCLC دارای گسترش موضعی یا متاستاز هستند. این افراد اغلب با ترکیبات شیمیدرمانی پلاتیندار (به عنوان مثال سیسپلاتین، کربوپلاتین یا اکسالیپلاتین) درمان میشوند که باعث ایجاد اتصالات متقاطع بین رشتههای دیانای میشوند. در میان افراد مبتلا به این نوع سرطان ریه، بیان کم ژن BRCA1 در تومور اولیه، با بهبود بقا پس از شیمی درمانی پلاتیندار در ارتباط است. این همبستگی آماری نشان میدهد که میزان کم BRCA1 در سرطان که به کاهش ترمیم دیانای منجر میشود، باعث آسیبپذیری سلولهای سرطانی به داروها (از طریق عوامل اتصالدهنده متقاطع دیانای) میشود. برعکس اگر سطح BRCA1 بالا باشد، ممکن است از طریق افزایش ترمیم دیانای، سلولهای سرطانی را در برابر داروهای شیمیدرمانی پلاتیندار محافظت کند؛ بنابراین میزان بیان BRCA1 ابزاری بالقوه مهمی برای طراحی و متناسبسازی نوع شیمیدرمانی و مدیریت درمان سرطان ریه است.
سطح بیان BRCA1 همچنین در درمان سرطان تخمدان نقش دارد. بیمارانی که سرطان تخمدان غیر ارثی دارند و با داروهای پلاتیندار تحت درمان هستند، در صورت کمبود بیان BRCA1 در مقایسه با بیمارانی که بیان BRCA1 بالاتری دارند، میانگین طول عمر بیشتری دارند (۴۶ ماه در مقایسه با ۳۳ ماه).
حق ثبت اختراع، اجرای قانونی، دعاوی و مجادلهها
یک تقاضانامه حق امتیاز برای جداسازی ژن BRCA1 و جهشهای تقویتکننده سرطان که پیشتر اشاره شد، و همچنین روشهایی برای تشخیص احتمال ابتلا به سرطان پستان، توسط دانشگاه یوتا، مؤسسه ملی علوم بهداشت محیط و میریاد جنتیکس در سال ۱۹۹۴ ثبت شد. یک سال بعد، شرکت میریاد (با همکاری پژوهشگران در «شرکت تحقیقاتی آندو»، «شرکت تحقیق و توسعه اچاس سی با مشارکت محدود» و دانشگاه پنسیلوانیا) ژن BRCA2 را جداسازی و توالیخوانی کرده و جهشهای کلیدی آن را شناسایی کرد و اولین حق امتیاز برای ژن BRCA2 را در سال ۱۹۹۵ ثبت کردند. شرکت میریاد دارای حق انحصاری این امتیاز ثبتشدهاست و آن را بهشدت از لحاظ قانونی در ایالات متحده آمریکا در برابر آزمایشگاههای تشخیص بالینی پیگیری و اعمال میکند. این مدل کسب و کار باعث شد که میریاد که در سال ۱۹۹۴ یک شرکت نوپا بود، به یک شرکت سهامی عام با ۱۲۰۰ کارمند و حدود ۵۰۰ میلیون دلار درآمد سالانه در سال ۲۰۱۲ تبدیل شود. علاوه بر این، اختلاف نظرها و بحثهایی دربارهٔ قیمتهای بالای این شرکت و ناتوانی درگرفتن نظر دوم از آزمایشگاههای تشخیصی دیگر پیش آمد، که به نوبه خود منجر به دعوای حقوقی انجمن برجسته آسیبشناسی مولکولی علیه شرکت میریاد شد. این حق امتیاز انحصاری در سال ۲۰۱۴ به پایان رسید.
مطابق مقاله منتشرشده در ژورنال علمی «ژنتیک پزشکی» در سال ۲۰۱۰، «قضیهٔ ثبت اختراع در خارج از ایالات متحده پیچیدهتر است… به عنوان مثال، با آنکه این حق امتیاز ثبت شدهاست، اما سیستمهای بهداشت استانی در کانادا این حق امتیاز را نادیده میگیرند. در استرالیا و انگلیس، شرکت میریاد اجازه استفاده از روشهایش را به سیستمهای بهداشتی داد اما از تغییر برنامههایش در اوت ۲۰۰۸ خبر داد. تنها یک جهش به عنوان حق انحصاری شرکت میریاد در سراسر اروپا ثبت شدهاست و سایر ثبت اختراعها به دنبال اعتراضهای شرکتهای رقیب، تحت بررسی هستند. در واقع، ایالات متحده آمریکا تنها حوزه قضایی است که در آن، شرکت میریاد از لحاظ پیگیری قانونی حق امتیاز خود موقعیت قوی دارد و آن را به شرکتی انحصاری در استفاده از این روشها مبدل ساختهاست.» پیتر ملدروم، مدیر عامل شرکت میریاد جنتیکس، اذعان کردهاست که شرکتش «مزایای رقابتی دیگری نیز دارد که ممکن است چنین پیگیریهای قانونی برای حق امتیازهایش را در اروپا غیرضروری کند».
مانند هر ژنی، یافتن تنوع و گوناگونی ژنی در BRCA1 کار چندان دشواری نیست. ارزش واقعی این کار در آن است که بدانیم عواقب بالینی این تنوع ژنی چیست. شرکت میریاد دارای یک پایگاه دادهٔ بزرگ و اختصاصی از چنین ارتباطاتی میان ژنوتیپ-فنوتیپ است. در پاسخ، پایگاههای دادهای منبع-باز دیگری در حال شکلگیری و توسعه هستند.
تصمیمات قانونی پیرامون حق انحصاری ثبت اختراع برای ژنهای BRCA1 و BRCA2 بهطور کلی بر آیندهٔ آزمایشهای ژنتیکی تشخیصی تأثیر میگذارد. مقاله ای در ژوئن ۲۰۱۳ دربارهٔ دعوای حقوقی انجمن برجسته آسیبشناسی مولکولی علیه شرکت میریاد (شماره ۱۲–۳۹۸)، حکم متفقالقول دیوان عالی ایالات متحده آمریکا را منتشر کرد: «یک بخش طبیعی از دیانای (یعنی ژنها)، محصولی از طبیعت است و مستحق اعطای حق انحصاری به یک شرکت نمیشود؛ فقط به این دلیل آن شرکت توانسته، آن بخش را جداسازی کند» و بدین ترتیب حق انحصاری شرکت میریاد برای ژنهای BRCA1 و BRCA2 باطل شد. با این حال، دادگاه همچنین اعلام کرد که دستکاریهای ژن برای ایجاد چیزی که در طبیعت یافت نمیشود، میتواند واجد شرایط اعطای حق ثبت اختراع باشد. دادگاه فدرال استرالیا نظری کاملاً متفاوت داشت و حق امتیاز انحصاری این شرکت برای ژن BRCA1 را در استرالیا در فوریه ۲۰۱۳ تأیید کرد و درخواست تجدیدنظر در این حکم را نیز در سپتامبر ۲۰۱۴ رد کرد. سرانجام در ۷ اکتبر ۲۰۱۵، «ایوان دارسی» دادخواست خود را علیه شرکت بیوتکنولوژی آمریکایی میریاد جنتیکس در دادگاه عالی استرالیا برنده شد. در حکمی متفقالقول این دادگاه، اظهار داشت که «دادگاه عالی دریافت که اسید نوکلئیک منفرد که کُدکنندهٔ پروتئین BRCA1 و دارای تغییرات خاص از هنجاری طبیعی خود است که نشانگر افزایش احتمال ابتلا به سرطان پستان و سرطان تخمدان است، واجد شرایط اعطای حق انحصاری و ثبت اختراع نیست.
تعاملهای شیمیایی
پروتئین BRCA1 با مولکولهای زیر دارای تعامل پروتئین-پروتئین است:
- ABL1
- AKT1
- گیرنده آندروژن
- ATR
- ATM
- ATF1
- BACH1
- BARD1
- BRCA2
- BRCC3
- BRE
- BRIP1
- C-jun
- CHEK2
- CLSPN
- COBRA1
- CREBBP
- CSNK2B
- CSTF2
- CDK2
- DHX9
- ELK4
- EP300
- ESR1
- FANCA
- FANCD2
- FHL2
- H2AFX
- JUNB
- JunD
- LMO4
- MAP3K3
- MED1
- MED17
- MED21
- MED24
- MRE11A
- MSH2
- MSH3
- MSH6
- Myc
- NBN
- NMI
- NPM1
- NCOA2
- NUFIP1
- پی۵۳
- PALB2
- POLR2A
- PPP1CA
- Rad50
- RAD51
- RBBP4
- RBBP7
- RBBP8
- RELA
- RB1
- RBL1
- RBL2
- RPL31
- SMARCA4
- SMARCB1
- STAT1
- UBE2D1
- USF2
- VCP
- XIST
- ZNF350
پیوند به بیرون
| در ویکیانبار پروندههایی دربارهٔ BRCA1 موجود است. |
- BRCA1 Protein در سرعنوانهای موضوعی پزشکی (MeSH) در کتابخانهٔ ملی پزشکی ایالات متحدهٔ آمریکا
- Genes, BRCA1 در سرعنوانهای موضوعی پزشکی (MeSH) در کتابخانهٔ ملی پزشکی ایالات متحدهٔ آمریکا
|
نگارخانه PDB
| |
|---|---|
|