کشت سهبعدی سلول
کشت سهبُعدی سلول ایجاد محیطی مصنوعی است که در آن سلولها بتوانند در هر سه بُعد رشد کنند و بر محیط اطرافشان تأثیر بگذارند. بر خلاف محیط دو بعدی (مثل پتری دیش)، یک محیط کشت سهبعدی به سلولها این اجازه را میدهد که در فضای برونتنی در همهٔ جهتها رشد کنند، درست مانند شرایطی که در محیط درونتنی وجود دارد. این محیطهای کشت سهبعدی معمولاً در بیورآکتورها رشد پیدا میکنند. بیورآکتورها، کپسولهای کوچکی هستند که در آنها سلولها میتوانند بهصورت اسفروئید یا کلونیهای سهبعدی رشد کنند. تقریباً ۳۰۰ اسفروئید در شرایط معمول در هر بیورآکتور کشت داده میشود.
پیشینه
مطالعات اولیه در دههٔ ۱۹۸۰ میلادی توسط مینا بیسل از آزمایشگاه ملی لارنس برکلی، اهمیت تکنیکهای سهبعدی را برای ساخت مدلهای کشت درونکشتگاهی صحیح، برجسته ساخت. این کار بر روی اهمیت ماتریکس خارج سلولی و توانایی کشتها در ماتریکسهای سهبعدی مصنوعی، در تولید ساختارهای چندسلولی مرتبط فیزیولوژیکی همانند ساختارهای آسینار در مدلهای سالم و سرطانی بافت پستان، متمرکز بود. این تکنیکها در مدلهای درونکشتگاهی که برای ارزیابی پاسخهای سلولی به ترکیبات دارویی استفاده شده بودند، اعمال گردیدند.
اریک سیمون (در ۱۹۸۸ در یک گزارش گرنت NIH SBIR) نشان داد که میتوان از الکتروریسی برای تولید حصیرهای فیبری پلیاستیرنی و پلیکربناتی در ابعاد نانو و سابمیکرون استفاده کرد (امروزه به عنوان داربست شناخته میشود) که بهطور ویژه میتوان از آنها به عنوان سوبستراهای سلولی درونکشتگاهی استفاده کرد. این استفادهٔ اولیه از توریها و شبکههای فیبری الکتروریسیشده برای کشت سلول و مهندسی بافت نشان داد که انواع متفاوتی از سلولها شامل سلولهای HFF HEp_2 و MLE به فیبرها متصل خواهند شد و تکثیر خواهند کرد. فهمیده شد که برخلاف مورفولوژی مسطحی که معمولاً در کشتهای دوبُعدی میبینیم، سلولهایی که بر روی فیبرهای الکتروریسیشده رشد داده شده بودند، یک مورفولوژی بیشتر گِرد و سهبعدی که شبیه به بافت بود را نشان دادند که این حالت معمولاً در محیطهای درونتنی مشاهده میشود.
ویژگیها
در بافت زنده، سلول در یک محیط زیستی سهبعدی با روابط پیچیده و در هم سلول-سلول و سلول-ماتریکس، و دینامیک حمل و نقل پیچیدهای برای مواد مغذی و سلولها قرار دارد. محیط کشت دوبعدیِ استاندارد یا تکلایهای برای ترسیم این محیط کافی نیست؛ این مسئله باعث شدهاست که این محیطها معمولاً پیشبینیکنندههای قابل اطمینانی برای بررسی عملکرد و سمیت داروها در شرایط درونتنی نباشند. اسفروئیدهای سهبعدی شباهت بیشتری با شرایط درونتنی از نظر ارتباطات سلولی و ایجاد ماتریکس خارج سلولی دارند. این ماتریکسها کمک میکنند که سلولها همانگونه که در بافت زنده حرکت میکنند در داخل اسفروئیدهایشان هم حرکت کنند. بدین ترتیب اسفروئیدها مدلهای ارتقایافتهای برای مهاجرت سلولی، تمایز، بقا و رشد سلولها هستند. به علاوه، کشتهای سهبعدی سلول ترسیم دقیقتری را از قطبیت سلولی فراهم میکنند، حال آنکه در محیط دوبعدی، سلول تنها میتواند بهطور جزئی قطبیت پیدا کند. علاوه بر این، سلولهای رشدیافته در محیط سهبعدی، بیان ژن متفاوتی را از آنهایی که در محیط دوبعدی کشت داده شدهاند، نشان میدهند. سومین بعدِ رشد سلول، ارتباط فضایی بیشتری را برای ورودیهای مکانیکی و چسبندگی سلولی فراهم میکند که این امر برای اتصال اینتگرینها، انقباض سلولی و حتی پیامرسانی درون سلولی ضروری است. انتشار طبیعی حلشونده و اتصال آن به پروتئینهای effector (مثل فاکتورهای رشد و آنزیمها) نیز همچنین وابسته به ماتریکس سهبعدی سلول است، بنابراین بعد سوم برای ساخت شیب غلظت حلشونده در ابعاد بافتی نیز ضروری است. برای مقاصد غربالگری سمشناسی داروها، بررسی بیان ژن سلولهایی که در محیط برونتنی سهبعدی رشد یافتهاند سودمندتر از سلولهای رشدیافته در محیط دوبعدی است، چراکه بیان ژن در اسفروئیدهای سهبعدی بیشتر به بیان ژن در محیط درونتنی شبیه خواهد بود. محیطهای کشت سهبعدی ثبات و طول عمر بهتری از محیطهای کشت دوبعدی دارند. این به این معناست که آنها برای مطالعات طولانیمدت و نشان دادن اثرات طولانیمدت داروها مناسبترند. محیطهای سهبعدی همینطور به سلولها اجازه میدهند که بدون اختلال رشد کنند حال آنکه در محیطهای دوبعدی، سلولها نیاز به اجرای منظم تریپسینسازی پروتئازها دارند تا مواد مغذی کافی و رشد سلولی طبیعی برایشان فراهم شود. اسفروئیدهای سهبعدی تا ۳۰۲ روز در یک آزمایشگاه، کشت داده شدهاند؛ در حالیکه هنوز سالم باقی ماندند و بدون سرطانی شدن، رشد داشتند.
روشها
امروزه، تعداد زیادی ابزار کشت که ادعا میکنند مزیتهای کشت سهبعدی را فراهم میکنند، بهصورت تجاری در دسترساند. بهطور کلی، اساس این شیوهها میتواند به دو نوع از روشهای کشت سهبعدی وابسته به داربست و روشهای مستقل از داربست، تقسیم شود.
تکنیکهای وابسته به داربست
تکنیکهای وابسته به داربست شامل استفاده از داربستهای جامد، هیدروژلها و سایر مواد میشود.
هیدروژلها
از آنجایی که ماتریکس خارج سلولی طبیعی برای بقا، تکثیر، تمایز و مهاجرت سلولها مهم است، ماتریکسهای مختلف هیدروژلی که ساختار ماتریکس خارج سلولی طبیعی را تقلید میکنند، بهعنوان رویکردهای بالقوهای در جهت کشت سلولی شبهدرونجانداری (in vivo)، شناخته میشوند. هیدروژلها از شبکهٔ به هم متصلی از حفرات تشکیل شدهاند که با حفظ و احتباس بالای آب، انتقال مؤثر موادی مثل مواد مغذی و گازها را ممکن میسازند. انواع مختلفی از هیدروژلها، از طبیعی گرفته تا سنتزشده، برای کشتهای سهبعدی در دسترس است؛ بهطور مثال مواردی شامل: هیدروژلهای استخراجشده از ECM حیوانات، هیدروژلهای پروتئینی، هیدروژلهای پپتیدی، هیدروژلهای پلیمری و هیدروژل نانوسلولوزی بر پایهٔ چوب.
تکنیکهای مستقل از داربست
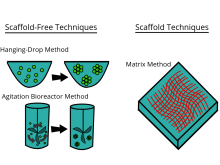
تکنیکهای مستقل از داربست، رویکرد دیگری را که غیروابسته به استفاده از داربست است، به کار میگیرند. تکنیکهای مستقل از داربست بهطور مثال شامل موارد زیر میشوند: پلیتهای با چسبندگی کم، پلیتهای هنگینگ دراپ، سطحهای دارای ریزالگو، بیورآکتورهای چرخان، شناوری مغناطیسی و چاپ زیستی سهبعدی مغناطیسی.
اسفروئیدها

اسفروئیدها نوعی مدلسازی سلولی سهبعدی هستند که شرایط یک محیط سلولی زنده را در مقایسه با مدل سلولی دوبعدی، بهتر شبیهسازی میکنند، بهخصوص در زمینهٔ برهمکنشهای بین سلولها و واکنشهای بین سلولها و ماتریکس. اسفروئیدها در زمینهٔ مطالعهٔ تغییرات فیزیولوژیکی ویژگیهای سلولها، کاربرد دارند. همچنین در مطالعهٔ تفاوتهای ساختاری سلولهای سالم و سلولهای توموری و تغییراتی که سلولها در هنگام توموری شدن ایجاد میکنند نیز کاربردی هستند. سختی، یکی از ویژگیهایی است که برای سنجش سلولهای سرطانی بهکار میرود. مطالعاتی که بر روی اسفروئیدها با استفاده از موچینهای میکرومکانیکی صورت گرفتهاست نشان میدهد که اسفروئیدهای BT474 و T47T (سرطان پستان) ۳ تا ۶ برابر نرمتر از اسفروئیدهای MCF 10A (بافت پوششی طبیعی) هستند. از اسفروئیدهایی که در آنها کشت همراه سلولهای سرطانی و سالم بودهاست برای شبیهسازی برهمکنش سلولهای سرطانی با سلولهای سالم استفاده شدهاست.
اسفروئیدها میتوانند با استفاده از چند شیوهٔ مختلف، کشت داده شوند. یک روش متداول، استفاده از پلیتهای با چسبندگی سلولی کم (معمولاً یک پلیت ۹۶ ول برای تولید انبوه کشتهای اسفروئیدی، که تجمعات در کف گرد پلیت سلولی تشکیل میشوند) است. اسفروئیدها همچنین میتوانند با استفاده از شیوهٔ هنگینگدراپ (Hanging drop)، کشت داده شوند؛ این شیوه شامل تشکیل تجمعات سلولی در قطراتی است که از سطح پلیت سلولی آویزاناند. یکی دیگر از شیوههای در دست بررسی، شامل استفاده از بیورآکتورهای با ظرف دارای دیوارهٔ چرخان است که میچرخند و سلولها را کشت میدهند و آنها پیوسته در سقوط آزاد هستند و تجمعات را در چند لایه شکل میدهند.
ریزسیالها
ساختارهای مختلف سلولی در بدن انسان، نیاز دارند که حتماً رگزایی داشته باشند تا بتوانند مواد مغذی را دریافت کنند و تبادلات گازی را که به بقایشان کمک میکند، انجام دهند. به همین شیوه، کشتهای سهبعدی سلول در محیطهای برونتنی نیز نیاز به سطوح مشخصی از گردش مایع دارند. نبود چنین گردشی در محیطهای سهبعدی و متراکم که ممکن است همهٔ سلولها بهطور مناسبی در معرض مواد مغذی قرار نگیرند، میتواند مشکلساز باشد. این مسئله خصوصاً در مورد کشت هپاتوسیتها اهمیت دارد چرا که کبد اندامی است که سیستم عروقی وسیعی دارد. در یک مطالعه، سلولهای هپاتوسیت و سلولهای عروقی با هم در داربستی کلاژنی در بین کانالهای میکروفلوئیدیک، کشت داده شدند و رشد سلولها در محیط ایستا با محیط دارای جریان مقایسه شد؛ و نیاز به مدلهایی با بافتها و ریزشبکههای عروقی نشان داده شد.
انتقادها
هیچیک از تکنیکهای سهبعدی تا کنون نتوانستهاست در مقیاسی وسیع، جایگزین تکنیکهای دوبعدی شود؛ این مسئله فرایندهای اکتشاف دارو را نیز شامل میشود. تکنیکهای سهبعدی حاضر، بدون محدودیت نیستند. این محدودیتها شامل مواردی نظیر مقیاسپذیری (انجام فرایند در مقیاسهای دلخواه)، تکرارپذیری، حساسیت و سازگاری با دستگاههای غربالگری با توان بالا (HTS) میشود. HTS مبتنی بر سلول، بر پایهٔ تعیین سریع پاسخ سلول به برهمکنش آن با دارو استوار است (مثل توان زیستن سلول در دوزهای مختلف، برهمکنش سلول-سلول و سلول-ماتریکس یا مهاجرت سلولی)، اما تستهای در دسترس فعلی برای کشت سلولی سهبعدی، بهینهسازی نشدهاند. چالش دیگری که پیش روی کشت سهبعدی است، تعداد کم دادهها و انتشاراتی است که در مورد مکانیسمهای برهمکنش دارو، تمایز سلولی و پیامرسانی سلولی در محیط سهبعدی in vitro سخن میگویند و همبستگی نتایجشان را با پاسخ دارو در محیط in vivo میسنجند. اگر چه تعداد موضوعات منتشر شده در مورد کشت سهبعدی سلول بهسرعت در حال افزایش است، اما تعیین مشخصات بیوشیمایی محدود فعلی برای بافتهای سهبعدی، اعتماد لازم برای پذیرش شیوههای سهبعدی را بهعنوان تکنیکی جدید، کاهش میدهد. به هر میزان که این چالشها برآورده شوند، به همان سرعت هم کشت سهبعدی سلول بهعنوان ابزاری متداول پذیرفته میشود.
در مورد استفاده از اسفروئیدها بهعنوان مدلهای سرطانی نیز مشکلاتی وجود دارد. با وجود مزیتهای کشت بافت سهبعدی، از اسفروئیدهای سهبعدی بهعلت چالشبرانگیز یا غیرممکن بودن کنترل دقیق گرادیان مولکولهای حلشده در سازهٔ اسفروئیدی و تعیین دقیق ویژگی سلولها در این گرادیانهای پیچیده انتقاد میشود.
- کتاب کشت سهبعدی سلول: اصول و روشها. تألیف اسماعیل صدرالدینی و همکاران.
- کتاب کشت سهبعدی سلول: جان هایکوک، ترجمهٔ اسماعیل صدرالدینی و همکاران