شبهاندام مغزی
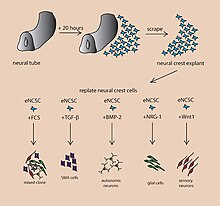
شبهاندام مغزی یا اُرگانویید مغزی (به انگلیسی: cerebral organoid) نوعی اندام مینیاتور شده و مصنوعی است، که در آزمایشگاه تولید میشود و شبیه مغز میباشد. ارگانوییدهای مغزی از طریق کشت سلولهای بنیادی پرتوان در بیورآکتورهای چرخشی و پس از گذشت چند ماه ایجاد میشوند.مغز انسان یک سیستم بسیار پیچیده از بافتهای هتروژن است و شامل انواع مختلفی از یاختههای عصبی میباشد. این پیچیدگی مطالعه مغز و نحوه کار آن را سخت کردهاست مخصوصاً هنگامی که این موضوع با بیماریهای نورودژنراتیو مرتبط میشود. هدف از ایجاد این مدلهای نورولوژیک in vitro مطالعه این بیماریها در یک فضای سادهتر و قابل تغییر و بدون محدودیتهای شرایط in vivo مخصوصاً هنگام کار با انسان. تفاوتهای میان فیزیولوژی انسان و سایر مدلهای پستاندار امکان مطالعه بیماریهای نورولوژیک را محدود میکند. شبه اندامهای مغزی بافتهای سنتز شدهای هستند که حاوی انواع مختلفی از یاختههای عصبی و همینطور ساختارهای آناتومیکی میباشند که شبیه مغز پستانداران میباشد. شبه اندامهای مغزی بیشترین شباهت را به لایههای از یاختههای عصبی که به آنها قشر مغز (کورتکس) و شبکه کورویید گفته میشود، دارند. در برخی از موارد ساختارهایی شبیه به شبکیه، مننژ و هیپوکامپ نیز میتواند ایجاد شود. سلولهای بنیادی این توانایی را دارند که رشد کنند و به بافتهای مختلفی در بدن تبدیل شوند و سرنوشت نهایی آنها به فاکتورهای مختلفی بستگی دارد. در تصویر زیر برخی از عوال شیمیایی که میتوانند موجب تمایز سلولهای بنیادی به انواع بافتهای عصبی شوند آمدهاست. تکنیکهای مشابهی که برای تمایز سلولهای بنیادی استفاده میشود، برای رشد و ایجاد شبه اندامها نیز به کار گرفته میشود..
ایجاد مدل
استفاده از سلولهای بنیادی پرتوان برای ایجاد شبه اندامهای مغزی به پژوهشگران این اجازه را میدهد تا مکانیسمهای تکوینی فعلی بافت عصبی و همینطور ریشههای بیماریها نورولوژیک را بهطور مختصر بیان کنند. شبه اندامهای مغزی ابزارهای مناسبی جهت فهم پاتولوژی بیماری هستند. شبه اندامها میتوانند برای آزمایشهایی مورد استفاده قرار گیرند که مدلهای in vitro فعلی قابلیت انجام آن را ندارند یا برای آنها بیش از حد ساده میباشند و علاوه بر آن قابلیت انطباق بیشتری با انسان دارند تا موش یا سایر مدلهای پستاندار. بر اساس تاریخ، پیشرفتها اصلی که در رابطه با چگونگی کار مغز حاصل شدهاست ناشی از آسیبها یا بیماریهای عملکردی مغز بوده که منجر به فهم عملکرد نواحی مختلف مغز شدهاست. یک مدل in vitro مغز میتواند منجر به موج دیگری از فهم مغز انسان شود.
کاربردها
علاوه بر استفاده از آن در فهم پاتولوژی بیماریها و درمان آنها، میتوان در آینده آن را بهطور مستقیم به یک میزبان مانند انسان پیوند زد. ارگانویید میتواند در نواحی آسیب دیده با بافت میزبان ادغام شود و با سیستم عروقی درآمیزد درحالی که از نظر ایمونولوژیک منجر به پاسخ نشود. لیستی از کاربردهای بالقوه شبه اندامهای مغزی در زیر آورده شدهاست. کاربردهای بالقوه:
- ریخت زایی بافت
- ریخت زایی بافتی با توجه به ارگانوییدهای عصبی بیشتر شامل نحوه شکلگیری اندامهای عصبی در مهره داران میشود. ارگانوییدهای مغزی میتوانند به عنوان ابزارهای در محیط برای مطالعه نحواه شکلگیری به کار گرفته شوند و با دستکاری آنها میتواند مکانیسمهای در گیر را بیشتر فهمید.
- سنجش میزان مهاجرت
- شبه اندامهای مغزی میتوانند به مطالعه مهاجرت سلولی کمک کند. سلولهای گلیال بخش عمده ای از یاختههای عصبی را تشکیل میدهند که برخی از آنها به اطراف نورونها میروند. فاکتورهای تأثیرگذار در حرکت این سلولها را میتوان با استفاده از این شبه اندامها بررسی کرد.
- تعقیب لاین تکثیری
- تعقیب لاین تکثیری بخشی از نقشهبرداری سرنوشت سلول میباشد که در آن دودمان و لاین سلولی در بافتهای تمایز یافته تا رسیدن به سلولهای پروژنیتور یا نیایاخته بررسی میشود. مکانیسمهای تمایزی را با استفاده از این شبه اندامها میتوان مطالعه کرد.
- پیوند
- ارگانوییدهای مغزی میتوانند رشد کنند و به نواحی مختلف مغزی تبدیل شوند و سپس به عنوان یک رویکرد درمانی میتوان آن هارا به نواحی نورودژنراتیو مغز پیوند زد.
- تفاوتهای زمانی تکوین میان گونهها
- این شبه اندامها میتوانند برای بررسی زمانبندی تکوین سیستم عصبی مورد استفاده قرار گیرند و میتوان به عنوان ابزاری برای درک تفاوتهای تکوینی میان گونهها از آنها استفاده کرد.
- غربالگری داروها در مقادیر زیاد
- شبه اندامهای مغزی میتوانند به عنوان مدلهای ساده ای از بافتهای پیچیده مغزی برای مطالعه تأثیرات داروها و غربال اولیه آنها جهت بررسی ایمنی و اثرگذاری آنها مورد استفاده قرار گیرند.
- سلول درمانی جایگزینی
- این شبه اندامها میتوانند به عنوان مدلهای ساده ای جهت بررسی تأثیرات سلول درمانی جایگزینی روی مغز مورد استفاده قرار گیرند.
- آزمایشهای ژنومی اختصاصی سلول
بیماری
میتوان از شبه اندامها برای بررسی مراحل حیاتی و اولیه تکوین مغز، بررسی داروها و به علت این که از سلولهای زنده تشکیل شدهاند میتوان از آنها برای مطالعه بیماران به طورت فردی کرد.
میکروسفالی
در یک مورد، پس از ایجاد یک شبه اندام از یک بیمار با میکروسفالی نشان داده شد که علت ایجاد علائم بیماری تکوین سریع مغز و در پی آن کاهش رشد آن میباشد. میکروسفالی یک نقص تکوینی میباشد که منجر به کاهش سایز مغز میشود و در نتیجه آن کاهش سایز سر اتفاق میافتد. میکروسفالی برای مدلهای موشی مناسب نمیباشد زیراکه نمیتوانند این شرایط را شبیهسازی کنند. به نظر میرسد فرم اولیه بیماری ناشی از یک جهش در ژن میکروسفالین باشد. ایجاد این بیماری در مدلهای موشی سخت میباشد زیرا موشها فاقد مراحل تکوینی بزرگ شدن قشر مغز میباشند. طبیعتاً بیماری ای را که این مرحله از تکوین را تحت تأثیر قرار میدهد نمیتوان در مدلی که فاقد آن میباشد، بررسی کرد. برای استفاده از ارگانوییدهای مغزی در مدل کردن میکروسفالی در انسان، گروهی از محققین سلولهای فیبروبلاست بیماران را گرفتند و آنها را با استفاده از چهار فاکتور معروف، دستکاری کرده و به حالت پرتوان مجدداً بازگرداندند. این فاکتورها شامل: oct4,sox2,c-myc,klf4 میباشد. سلولهای پرتوان جدید دوباره کشت داده شدند و به ارگانوییدهای مغزی طی فرایندی که در پایین توضیح داده شده آیت تبدیل شدند. ارگانوییدهای مغزی به دست آمده کاهش سلولهای پروژنیتور و همینطور بافتهای کوچکتری را از خود نشان دادند. بعلاوه بافتهای به دست آمده از بیماران بافتهای نورواپی تلیالی ساخته شده از پروژنیتور کمتر، کاهش سلولهای بنیادی گلیال شعاعی و افزایش نورونها را نشان دادند. این نتایج نشان دهنده این بود که ایجاد این بیماری، ناشی از تمایز زودرس سلولهای بنیادی به نورونها میباشد که منجر به نقص در سلولهای گلیال شعاعی میشود.
بیماری آلزایمر
پاتولوژی بیماری آلزایمر هم با استفاده از این شبه اندامها مدل شدهاست. سلولهای بنیادی پرتوان افراد مبتلا برای ایجاد ارگانوییدها مورد استفاده قرار گرفت و با مدلهای کنترل که از افراد سالم به دست آمده بود مقایسه شد. مشخص شد که در مدلهای مبتلا ساختارهای مشابه پلاکهای آمیلوئید بتا و نوروفیبریلاری تانگلها که عامل ایجاد علائم بیماری میباشند ایجاد میشود. تلاشهای قبلی برای مدلسازی این بیماری با دقت بالا موفق نبودند و داروهایی که بر اساس اثرگذاری بر مدلهای پرکلینیکال مانند موش ایجاد شده بودند نیز تأثیری در کارآزماییهای بالینی انسان نداشتند.
اوتیسم
بهطور مشابهی، از طریق مقایسه ارگانوییدهای مغزی سالم و غیر سالم مورد مطالعه قرار گرفتهاست. بررسی هر دو مدل نشان دهنده افزایش میزان بیان فاکتور رونویسی FOXG1 که منجر به افزایش تعداد نورونهای گابائرژیک در مدلهای مبتلا میشود، بود. اهمیت استفاده از این شبه اندامهای مغزی، تقویت نظریه عدم تعادل نورونهای تحریکی/مهاری در بیماری اوتیسم میباشد که اگر ثابت شود میتواند به پیدایش اهداف دارویی در درمان بیماری کمککننده باشد.
ساخت ارگانوییدها
برای ایجاد یک شبه اندام، امبریوئید یا شبه جنینی (بافتی که برخی خصوصیات جنینی را حفظ کردهاست) که از بافت عصبی ایجاد شدهاست مورد استفاده قرار میگیرد. جنین از سه لایه اندودرم، مزودرم و اکتودرم تشکیل میشود. هر کدام از این لایهها بخشهای مختلف بدن را میسازند. سیستم عصبی از اکتودرم ایجاد میشود (که سازنده اپی درم پوست و مینای دندان نیز میباشد). سلولهای اکتودرمال در قطراتی از ژل گزاشته شده و در مایع حاوی مواد مغذی در یک بیورآکتور چرخشی که رشد سلولها را پشتیبانی میکند گذاشته شدند. پس از ده روز ارگانویید نورونها را ایجاد کرد. پس از ۳۰ روز نواحی ایجاد کرد که به بخشهای خاصی از مغز شباهت داشتند. بدون حضور گردش خون به اندازه حدو ۴ میلیمتر میرسند و میتوانند تا یک سال یا بیشتر زنده بمانند. کل فرایند میتواند به پنج مرحله تقسیم شود. در ابتدا سلولهای بنیادی پرتوان انسانی کشت داده میشوند. به آنها اجازه داده میشود که یک امبریوئید بادی (ساختارهای کروی چند سلولی و پرتوان) ایجاد کنند. پس از آن کشت سلولی به سمت نورواکتودرم القا میشود. پس از آن نورواکتودرم در یک قطره ماتریژل رشد میکند. ماتریژل مواد غذایی مورد نیاز را فراهم میکند و نورواکتودرم شروع میکند به رشد و تکثیر. اما نبود ساختارهای عروقی اندازه و سایزی که شبه اندام میتواند رشد کند را محدود میسازد. این محدودیت اصلی در ساخت ارگانوییدها میباشد اما با این حال تکنیکهای جدید مثل استفاده از بیورآکتورهای چرخشی میزان مواد غذایی بیشتری در اختیار سلولهای درونی ارگانویید قرار میدهند. این مرحله یعنی آخرین مرحله پیشرفت اصلی در ایجاد ارگانوییدها میباشد. بیورآکتورهای چرخشی بهطور افزاینده ای در کشت سلولها و تکثیر بافتها مورد استفاده قرار میگیرند. رآکتور منجر به تسریع زمان دو برابر شدن سلولها، افزایش تکثیر سلولی و افزایش اجزای ماتریکس خارج سلولی در مقایسه با سلولهای کشت شده به صورت استاتیک میشود.
شکل: این فلوچارت نشان دهنده مراحل اییجاد یک شبه اندام مغزی میباشد که چند این فرایند به طول میانجامد و عامل محدودکننده اندازه آن عدم تغذیه سلولهای داخلی میباشد. این تکنیک در ابتدا توسط مادالین لنکستر ارائه شد و تا به امروز دچار تغییراتی نیز شدهاست. روشهای جدید تر این امکان را یه وجود آوردهاند که بتوان ارگانوییدهای مغزی-عروقی را ایجاد کرد.
آزمایش
تمایز
نشان داده شدهاست که ارگانوییدهای مغزی که از طریق بیورآکتورهای چرخشی ایجاد میشوند، به بخشهای مختلف بافت عصبی از جمله کاپ بینایی، هیپوکامپ، قسمتهای شکمی تلنسفال و قشر خلفی مغز تمایز مییابند. سلولهای بنیادی/پروژنیتور عصبی بسیار متمایز میباشند از این جهت که قابلیت خودنوزایی دارند و چندتوان میباشند. این به این معنی است که میتوانند نورونها و سلولهای گلیال را که در جز اصلی از سیستم عصبی میباشند را ایجاد کنند. سرنوشت این سلولها توسط عوامل متعددی که بر روی فرایند تمایز اثر میگذارند، کنترل میشود. ویژگیهای مکانی و زمانی سلولهای پروژنیتور میتواند بر این که این سلولها به نورون یا سلول گلیال تبدیل شوند، تأثیر بگذارد. پس از آن تمایز بیشتر تحت تأثیر شرایط خارج سلولی و سیگنالینگ یا پیامدهی سلولی میباشد. شرایط و تحریکات مورد نیاز برای تبدیل سلولهای پروژنیتور عصبی به بافتهای ویژه عصبی مانند هیپوکامپ، عصب بینایی، قشر مغز و… بهطور دقیق نامشخص است. گمان میرود استفاده از شبه اندامهای عصبی میتواند این مسیرهای تکوینی کمککننده باشد.
بیان ژن
برای بررسی این موضوع که آیا سلولهای بنیادی یا پروژنیتور عصبی در حال تمایز به بافتهای عصبی خاصی هستند، میتوان از نشانگر (مارکر)های ژنی خاصی استفاده کرد. دو مارکر ژنی که در دوران پرتوانی سلول بیان میشوند، شامل OCT4 و NANOG میباشد. بیان این دو نشانگر در حین تکامل سلولها به ارگانویید، کاه مییابد. مارکرهای عصبی، که نشان دهنده القا و تمایز موفق به بافت عصبی میباشند، شامل SOX1 و PAX6 میباشد که در حین تکامل ارگانویید افزایش مییابند. این تغییرات در بیان ژنها بیانگر این موضوع است که تمایز ارگانوییدها به نوعی یک تمایز خود هدایت شونده یا ذاتی میباشد. مارکرهای موجود برای مغز پسین و مغز پیشین نیز میتواند مورد آزمایش قرار گیرد. مارکرهای مغز پیشین شامل FOXG1 و SIX3 میباشد که در طی تمایز ارگانویید به میزان بالا بیان میشوند. اما مارکرهای مغز پسین که شامل EGR2 و ISL1 میباشد در ابتدا وجود دارند اما در مراحل بعدی کاهش مییابند. این عدم تعادل به سمت ایجاد مغز پیشین مشابه این اتفاق در انسان در دوران جنینی میباشد که منجر به گسترش بافت مغز پیشین میشود. برای بررسی این که آیا ارگانوییدها دچار تمایز بیشتر به سمت نواحی خاص قشر میشوند از ماکرهای قشر مغز و لوب پس سری (اکسیپیتال) استفاده شدهاست. بسیاری از نواحی که مارکر مغز پیشین یعنی FOXG1 را بیان میکردند، در واقع به عنوان نواحی از قشر مغز شناخته میشدند، علاوه بر آن برای مارکر قشر خلفی یعنی EMX1 نیز مثبت بودند. این نواحی میتوانستند با مارکرهای بیشتری نیز اختصاصی شوند مانند AUTS2، TSHZ2 و LMO4 که اولی نمایانگر قشر مغز و دو مارکر بعدی نشان دهنده لوب پس سری میباشند. مارکرهای ژنی برای هیپوکامپ، قسمت شکمی مغز پیشین و شبکه کوروئید نیز در ارگانوییدهای مغزی دیده شدهاست اما ساختار و شکل کلی این نواحی هنوز ایجاد نشدهاست.
لوکالیزاسیون
عملکردی
شبه اندامهای مغزی بعلاوه، نورونهای قشری دارای عملکرد را نیز ایجاد میکنند. این نورونها باید بر روی یک صفحه قشری سازماندهی شده شعاعی ایجاد شوند. مارکر TBR1 در صفحه ابتدایی، که پیش ساز صفحه قشری (کورتیکال) میباشد، به همراه MAP2 که یک مارکر عصبی میباشد، در ارگانوییدهای ۳۰ روزه بیان میشوند. این مارکرها نشان دهنده ایجاد لایه قاعده ای عصبی همانند صفحه ابتدایی میباشند. این سلولها به صورت راسی مجاور ناحیه خنثی میباشند و ریلین مثبت میباشند که نشان دخنده حضور سلولهای کژل-رتزیوس میباشد (Cajal-Retzius). این سلولها برای ابجاد ساختار صفحه قشری مهم میباشند. صفحه قشری معمولاً به صورت داخل به خارج ایجاد میشود، وو پس از آن نورونهایی که بعداً به وجود میآیند (جوانتر) به سمت لایههای سطحی و بالایی میآیند. این سازماندهی در ارگانوییدهای مغزی هم بر اساس مارکرهای ژنی وجود دارد. نورونهایی که در ابتدا به وجود میآیند، مارکر CTIP2 را بیان میکنند و در مجاورت سلولهای صفحه ابتدایی که TBR1 را بیان میکنند قرار میگیرند. نورونهایی که بعداً ایجاد میشوند حاوی مارکرهای SATB2 و BRN2 میباشند در لایههای سطحی قرار میگیرند، بسیار دور تر از صفحه ایتدایی نسبت به نورونهایی که در ابتدا ایجاد میشوند و این نشان دهنده سازماندهی صفحه قشری میباشد. بعلاوه ارگانوییدهای مغزی پس از گذشت ۷۵ روز از تشکیل آنها یک ناحیه ابتدایی و حاشیه ای و بدون سلول را نشان میدهند. تشکیل ساختار لایه ای در صفحه قشری در ارگانوییدها بسیار ابتدایی میباشد و نشان دهنده این موضوع میباشد که عوامل و فاکتورهای مورد نیاز برای القای تشکیل لایههای دوم تا ششم وجود ندارد. نورونهای ارگانوییدهای عصبی میتوانند تشکیل آکسون نیز بدهند، همانطور که از طریق رنگ آمیزی با GFP نشان داده شد. آکسونهای رنگ آمیزی شده حاوی شاخه زایی پیچیده و مخروط رویشی بودند. بعلاوه تصویر برداری با استفاده از رنگ کلسیم نشان داد که ارگانوییدهای مغزی دارای نوسانات کلسیم و پتانسیلهای خود به خودی در سلولهای عصبی میباشد. پیامرسانی کلسیم میتواند از طریق گلوتامات تسهیل و از طریق تترودوتوکسین مهار شود.
فیزیکی
هنوز کاملاً مشخص نشدهاست که بافتهایی که از سلولهای بنیادی ایجاد میشوند چگونه پس از تعامل با بافتهای اطراف منجر به ایجاد ارگان میگردند. اما این قضیه نشان داده شدهاست که تمایز بیشتر بافتها نیازمند برهمکنش با بافتهای اطراف است و این بستگی به فاکتورهای قابل انتشار و القایی دارد که یه میتوانند باعث القای تمایز یا مهار آن شوند. تمایز ارگانوییدهای مغزی کاملاً لوکالیزه و متمرکز میباشد. مارکرهایی که در بخش قبل برای مغز پیشین و پسین شرح داده شد، از نظر فیزیکی کاملاً لوکالیزه میباشند و به صورت دسته ای پدیدار میشوند. این نشان دهنده این است که با آزادسازی محرکها به صورت موضعی یک یا تعداد بیشتری سلول به سمت نوع خاصی تمایز مییابند که این در تضاد با مسیرهای تصادفی در بافت میباشد. مارکرهای اختصاصی شدن برای لوبهای مغز، قشر پرفرونتال و لوب پس سری، از نظر فیزیکی لوکالیزه و مشخص شدهاند. اما سلولهای هیپوکامپ و بخشهای شکمی مغز پیشین از نظر فیزیکی لوکالیزه نیستند و در ارگانوییدهای مغزی به صورت تصادفی قرار گرفتهاند. ارگانوییدهای مغزی عروق خونی ندارند و از نظر اندازه به علت کم رسیدن مواد غذایی به سلولهای عمقی محدود شدهاند. بیرآکتورهای چرخشی و تکنیکهای تولید داربست سه بعدی که میتوانند منجر به افزایش اندازه و سایز ارگانوییدها از طریق ادغام سیستمهای انتقال مواد غذایی in vitro شوند، احتمالاً پرش بعدی در ساخت و توسعه شبه اندامهای مغزی محسوب میشوند.
اصول اخلاقی
نگرانیهای اخلاقی برای استفاده از ارگانوییدهای مغزی به عنوان مدلهایی برای بیماری به عنوان توانایی بالقوه آنها برای ادراک درد یا توانایی ایجاد هشیاری افزایش یافتهاست. در حال حاضر بعید است که بتوان مدلهای ساده فعلی را با پیچیدگیهای مغز انسان مقایسه کرد، با این حال مدلهایی نیز ایجاد شدهاند که میتوانند به تحریکات ناشی از نور پاسخ دهند در نتیجه میتوان گفت که مدلهای فعلی تا حدی توانایی پاسخ به برخی تحریکات را دارند. اگر وجود این گونه حواس و ادراکات در این مدلها قابل اثبات باشد آن موقع میتوان میتوان نسبت به موارد اخلاقی مشکوک بود. اقدامات زیادی در حال انجام برای حل این سوالات میباشد مانند سمپوزیومی در دانشگاه آکسفورد که برای حل نگارانیهای اخلاقی در رابطه با این فناوری جدید برگزار شد. بهطور مشابه پروژههایی مانند brainstorm از دانشگاه کیس وسترن که هدف آنها بررسی پیشرفتهای حاصل در این شاخه با بررسی آزمایشگاههایی که با ارگانوییدهای مغزی کار میکنند، میباشد تا بتوانند چارچوب فلسفی کار با این فناوری را در آینده ایجاد کنند.
Content in this edit is from the existing English Wikipedia article at en:cerebral organoid; see its history for attribution.