ریزسیالشناسی دیجیتالی
ریزسیالشناسی رقومی یا میکروفلوئیدیک دیجیتال (Digital microfluidics) (DMF) یکی دیگر از پلتفرمهای سامانه آزمایشگاه روی تراشه (lab-on-a-chip) است که بر اساس تغییرات بر روی microdropletsها میباشد. قطرات بر روی یک پلت فرم با مجموعه الکترودهای مجزایی توزیع، منتقل، ذخیره و مخلوط شده، واکنش داده یا تجزیه و تحلیل میشوند. میکروفلوئیدیکهای دیجیتال میتوانند همراه با فرایندهای آنالیز شده تحلیلی مانند طیفسنجی جرمی، رنگ سنجی، الکتروشیمیایی و electrochemiluminescense مورد استفاده قرار بگیرند.
اساس کار
در مقایسه با دیجیتال میکروالکترونیک، دستورالعملهای اساسی میتوانند با سلسله مراتب طراحی سازه ترکیب شده و مورد استفاده مجدد قرار بگیرند تا فرایندهای پیچیده (مانند سنتز شیمیایی یا سنجش بیولوژیکی) به تدریج ساخته شوند؛ و در مقابل ریزسیالشناسی جریان مداوم، میکروفلوئیدیک دیجیتال بسیار شبیه شیوههای سنتی نیمکت- بالا کار میکند، تنها با حجم کوچکتر و اتوماسیون بسیار بالاتر. در نتیجه طیف گستردهای از شیمی و پرتوکلهای تأسیس شده در یک فرمت قطرات nanoliter منتقل میگردند. سه اصولی که معمولاً بیشتر از همه مورد استفاده قرار میگیرند شامل Electrowetting , dielectrophoresis و جریانهای مایع غیرقابل امتزاج هستند که برای ایجاد و تغییر بر روی microdroplets در دستگاه میکروفلوئیدیک دیجیتال میباشند.
تنظیمات ریزسیالشناسی دیجیتال (DMF) بستگی به بستر مورد استفاده، الکترودها، پیکربندی الکترودها، استفاده از مواد دی الکتریک، ضخامت مواد دی الکتریک، لایههای آبگریز و کاربردهای ولتاژ دارد.
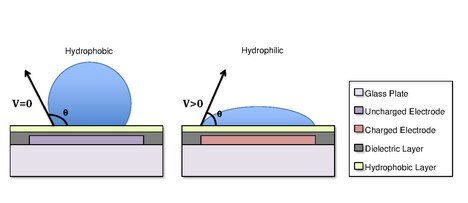
یک بستر که بهطور معمول در این نوع از سیستمها مورد استفاده قرار میگیرد، شیشه ای است. بسته به اینکه سیستم باز یا بسته باشد یک یا دو لایه شیشه وجود دارد. لایه پایین این دستگاه شامل یک الگوی آرایه به صورت الکترودهای قابل کنترل منفرد است. هنگامی که به سیستم بسته نگاه میشود، معمولاً یک الکترود زمینی مداوم در لایه بالایی که از اکسید ایندیوم قلع ساخته شدهاست، وجود دارد. لایه دی الکتریک تقریباً در لایه پایینی دستگاه وجود دارد و برای ایجاد شارژ و شیبهای میدان الکتریکی بر روی دستگاه اهمیت دارد. یک لایه آبگریز در لایه بالایی سیستم برای کاهش سطح انرژی در محلی که با قطرات در تماس اند، بکار گرفته شدهاست. اعمال ولتاژ، الکترودها را فعال کرده و مجوز تغییرات را در قابلیت تر شدگی قطرات بر روی سطح دستگاه میدهد. برای حرکت یک قطره، یک ولتاژ قابل کنترل برای یک الکترودی که در مجاورت با قطره است بکار گرفته شدهاست، و در همان زمان، الکترودی که زیر قطره است غیرفعال میگردد. با تغییر پتانسیل الکتریکی در امتداد آرایه خطی از الکترودها، electrowetting میتواند برای حرکت قطرات در امتداد این خط از الکترودها مورد استفاده قرار بگیرد.
تغییرات این شالوده، همچنین، میتواند مانند طراحی سازه پایه ساخته شود. یک مثال از این مورد اضافه کردن آشکارساز electrochemiluminescence به لایه اکسید ایندیم قلع (الکترود زمینی در سیستم بسته) است که کمک به تشخیص luminophores در قطرات مینماید. بهطور کلی مواد مختلفی نیز ممکن است به جای اجزای اصلی سیستم DMF مورد استفاده قرار گیرند مانند استفاده از PDMS به جای شیشه برای بستر. مواد مایع مانند روغن یا ماده دیگری نیز میتوانند به سیستم بسته برای جلوگیری از تبخیر مواد و کاهش آلودگی سطح اضافه شوند. همچنین، سیستمهای DMF با قطرات مایع یونی، با استفاده از روغن در دستگاه بسته یا با استفاده از زنجیر (یک سیم معلق) بر روی دستگاه DMF سازگار هستند.
اصول کار
قطرات توسط ویژگی کشش سطحی مایع تشکیل میشوند. برای مثال، آبی که روی سطح آبگریزی مانند کاغذ مومی قرار دارد برای کاهش تماس با سطح، تشکیل قطرات کروی شکل میدهد. تفاوت در آب گریزی سطوح در توانایی مایع بر انتشار و مرطوب نمودن سطح از طریق تغییر زاویه تماس اثر میگذارد. همینطور که آبگریزی سطح افزایش مییابد، زاویه تماس نیز افزایش میباید و توانایی قطره برای مرطوب نمودن سطح کاهش می یاید، این تغییر در زاویه تماس و در نتیجه مرطوب شدن، توسط معادله Young-Lipmann تنظیم میشود.

در برخی از موارد، آب گریزی یک بستر میتواند با استفاده از میدانهای الکتریکی کنترل شود. این موضوع به پدیدهٔ Electrowetting در دی الکتریک اشاره مینماید.[۳][۴]به عنوان مثال زمانی که هیچ میدان الکتریکی برای یک الکترود اعمال نمیشود، سطح آبگریز باقی خواهد ماند و یک قطره مایع کروی شکل تری با زاویه تماس بزرگتر تشکیل میشود. زمانی که میدان الکتریکی اعمال میشود یک سطح آبگریز قطبی ایجاد میشود. قطرات آب مسطح شده و زاویه تماس کاهش مییابد. . با کنترل مکان این قطبیت ما میتوانیم یک شیب کشش سطحی ای را ایجاد نماییم که اجازه کنترل جابه جایی قطره بر روی سطح دستگاه DMF را میدهد.
دستکاری قطرات
جابه جایی قطرات سه بعدی توسط تحریک الکترواستاتیک
تحریک قطرات سه بعدی توسط سیستم بسته امکانپذیر است. این سیستم حاوی قطره ای در اندازه میکرولیتر در محیط کشت مایع غیرقابل امتزاج است. سپس قطره و محیط کشت بین دو صفحه الکترومغناطیسی ساندویچ میشوند که یک میدان EM را بین دو صفحه ایجاد مینمایند. هدف از این روش انتقال قطره از یک سطح تخت پایینتر به سطح تخت موازی بالاتر و برگشت به پایین از طریق نیروهای الکترواستاتیک است. فیزیک پشت چنین ذرات تحریکی و جنبش عمودی توسط تلاشهای اولیه N. N. Lebedev و I. P. Skal'skaya قابل درک است. تحقیقات آنها مدلسازی بار الکتریکی ماکسول بود که توسط ذرات هادی کاملاً گرد در حضور یک میدان مغناطیس یکنواخت در نتیجه یک سطح کششی نامحدود و هادی مناسب بدست آمد. مدل آنها کمک به پیشبینی حرکت z مانند microdropletها در دستگاه مینماید، همچنان که به عظمت و جهت نیروهایی که بر فراز microdropletها فعالیت میکنند، اشاره مینماید. این میتواند برای کمک به پیشبینی دقیق و صحیح حرکات غیرقابل کنترل مورد استفاده قرار بگیرد. این مدل دلیل بکار نگرفتن پوشش دی الکتریک را بر روی یکی از دو سطوح که سبب برگشت بار در قطره در اثر تماس با هر الکترود میشود و به نوبه خود موجب جهیدن غیرقابل کنترل بین الکترودها میشود را توضیح میدهد.
در حال حاضر، ریزسیالشناسی دیجیتال به آسانی با بسیاری از رشتههای بیولوژیک سازگار شدهاست. با فعال کردن حرکات سه بعدی در DMF، این تکنولوژی میتواند حتی بهطور گستردهتری در کاربردهای بیولوژیکی مورد استفاده قرار بگیرد، همچنان که میتواند محیطهای میکروی سه بعدی را بهطور دقیقی تقلید نماید. امتیاز مهم استفاده از این نوع روش در دسترس بودن دو محیط متفاوت توسط قطره میباشد که وظایف میکروفلوئیدیک را بین دو سطح تقسیم میکند. برای مثال، زمانی که صفحه پایینی برای جنبش قطرات استفاده میشود، صفحه بالایی فرایندهای بیولوژیکی و شیمیایی لازم را انجام میدهد. این مزیت میتواند به پروتوکلهای آزمایشی عملی در جامعه بیولوژیکی ترجمه شود، مانند اتصال با تکثیر DNA. این همچنین، باعث کوچکتر شدن تراشه و آسانتر کردن کار محققان در طراحی پلت فرمها برای آنالیز microdropletها میشود.
(All-Terrain Droplet Actuation (ATDA
ریزسیالشناسی all-terrain روشی است که برای انتقال قطرات مایع بر روی انواع سطوح غیر سنتی استفاده میشود. بر خلاف پلت فرم میکروفلوئیدیک سنتی که بهطور کلی محدود به سطوح افقی و تخت هستند، ATDA تغییرات قطره را بر روی سطوح منحنی، غیرافقی و واژگون فراهم مینماید. این کار از طریق یکی کردن ورقههای نازک مس و پلی ایمید انعطافپذیر با سطح از طریق روش سریع prototyping امکانپذیر است. این دستگاه با بسیاری از مایعات بسیار خوب کار میکند، مانند بافرهای آبی، محلولهای پروتئینی و DNA و سرم گاوی رقیق نشده. ATDA سازگار با روغن سیلیکون یا مواد افزودنی pluronic مانند F-68 میباشد که جذب غیر اختصاصی و آلودگی را در هنگام برخورد با مایعاتی مانند پروتئین، سرمهای بیولوژیک و DNA کاهش میدهد. مشکل این تنظیم تبخیر سریع قطره میباشد. ATDA شکلی از میکروفلوئیدیک دیجیتال باز است که برای کاهش تبخیر قطره، بایستی در محیط مرطوب محصور شود.
اجرا
در یکی از تجسمهای مختلف مبتنی بر میکروفلوئیدیک تراشههای زیستی EWOD که اولین بار توسط Cytonix در سال 1987 [۱] بایگانیشده در ۱۹ سپتامبر ۲۰۲۰ توسط Wayback Machine بررسی گردید و پس از آن توسط برهان مایع پیشرفته به شکل تجاری درآمد، دو صفحه شیشه ای موازی وجود دارند؛ صفحه پایین شامل آرایههای الگودار الکترودهای قابل کنترل منفرد است، و صفحه بالایی پوشیده از الکترودهای زمینی مداوم میباشد. یک دی الکتریک عایق با پوشش آبگریز برای کاهش تر شوندگی سطح به صفحات و افزایش ظرفیت خازنی بین قطرات و کنترل الکترودها، اضافه میشود. قطراتی که حاوی نمونههای بیوشیمیایی و محیط کشت پرکننده هستند، مانند روغن سیلیکونی، یک روغن یا هوای فلوئوردار بین صفحات ساندویچ میشوند. قطرات داخل محیط کشت پرکننده حرکت میکنند. برای حرکت یک قطره، یک ولتاژ کنترلی به الکترودی که مجاور قطره است بکار برده میشود و بهطور همزمان، الکترودی که درست زیر قطره است غیرفعال میگردد. با تغییر پتانسیل الکتریکی در امتداد آرایههای الکترودی خطی، electrowetting میتواند برای حرکت قطرات در امتداد این خط الکترودها مورد استفاده قرار بگیرد.
موارد مورد استفاده
جداسازی و استخراج
ریزسیالشناسی دیجیتال برای جداسازی و استخراج آنالیتهای هدف میتواند مورد استفاده قرار بگیرد. این روشها شامل استفاده از ذرات مغناطیسیاستخراج مایع-مایعانبرک نوری و اثرات هیدرودینامیک هستند.
ذرات مغناطیسی
برای جداسازی ذرات مغناطیسی یک قطره از محلول حاوی آنالیت مورد نظر روی آرایه الکترودی میکروفلوئیدیک دیجیتال قرار گرفته و از طریق تغییرات بارهای الکترودها حرکت میکند. قطره به سمت الکترودی که در یک طرفش آرایه مغناطیس دارد و نقش آن ذرات مغناطیس اتصال به آنالیت میباشد، حرکت میکند. سپس به سمت دیگر الکترود حرکت کرده، میدان مغناطیسی برداشته شده و ذرات در قطره معلق میمانند. قطره بر روی الکترود برای اطمینان از آمیختگی میچرخد. مغناطیس مجدد ایجاد میشود و ذرات تثبیت میگردند و قطره به مکان دیگری میرود. این فرایند با شستشو و بافرهای شستشو برای استخراج آنالیت تکرار میگردد.
ذرات مغناطیس که با آنتیبادیهای آلبومین سرم ضد انسانی پوشیده شدهاند برای جداکردن آلبومین سرم انسانی برای تثبیت رسوب گذاری ایمنی immunoprecipitation در میکروفلوئیدیک دیجیتال، مورد استفاده قرار گرفتهاند. استخراج DNA از نمونه خونی کامل نیز با میکروفلوئیدیک دیجیتال به اجرا گذاشته شدهاست. 3 این فرایند روش کلی را به عنوان ذرات مغناطیس متابعت میکند اما تیمار اولیه در پلت فرم ریزسیالشناختی برای تجزیه سلولها قبل از استخراج DNA میبایستی که اتفاق بیفتد
استخراج مایع-مایع
استخراج مایع-مایع میتواند در دستگاه میکروفلوئیدیک دیجیتال از طریق استفاده از خاصیت مایعات غیرقابل امتزاج، انجام شود.9 دو قطره یکی حاوی آنالیت در فاز آبی، و دیگری حاوی یک مایع یونی غیرقابل امتزاج در آرایه الکترود وجود دارند. دو قطره با یکدیگر آمیخته شده و عصاره مایع یونی آنالیت و قطرات به راحتی قابل جدا شدن هستند.
انبرکهای نوری
انبرکهای نوری نیز برای جدا کردن سلولها در قطرات مورد استفاده قرار گرفتهاند.10 دو قطره در یک آرایه الکترود با یکدیگر آمیخته شده، یکی حاوی سلول و دیگری حاوی مواد غذایی و دارو است. قطرات آمیخته شده و انبرکهای نوری برای انتقال سلولها به یک طرف از قطرهٔ بزرگتر قبل از جدا شدن مورد استفاده قرار میگیرند.
استخراج هیدرودینامیکی
ذراتی که برای استفاده خارج از جداسازی مغناطیس، با نیروهای هیدرودینامیک برای جداسازی قطرات از یک توده قطره بکار برده شدهاند. این کار در آرایههای الکترود با یک الکترود مرکزی و برشی از الکترودها که آن را احاطه کردهاند صورت میگیرد. قطرات به آرایه اضافه شده و به صورت دوار میچرخند و نیروهای هیدرودینامیکی حاصل از چرخش سبب شده تا ذرات در الکترود مرکزی تجمع گردند.
استخراج زیستی
استخراج زیستی معمولاً نمونههای با غلظت کم و حجم بالا را شامل میشود. این موضوع میتواند مشکلی برای میکروفلوئیدیک دیجیتال به دلیل لزوم نمونه با حجم کم باشد. سیستم میکروفلوئیدیک دیجیتال میتواند با سیستم میکروفلوئیدیک ترکیب شده و برای کاهش حجم نمونه و افزایش غلظت آنالیت طراحی بشود. استخراج بیولوژیکی تابع همان اصول جداسازی ذرات مغناطیس میباشد اما شامل پمپ قطره برای گردش دواری حجم بزرگتری از مایع به دور ذرات مغناطیس میباشد. استخراج آنالیتهای دارویی از نمونههای ادرار خشک شده نیز گزارش شدهاست. یک قطره از حلال استخراجی، در این مورد متانول، مکرراً به روی یک نمونه از نمونه ادراری خشک شده به جریان گذاشته میشود و سپس به الکترود نهایی منتقل میگردد، جایی که مایع از طریق یک مویرگ استخراج شده و بعد با استفاده از اسپکترومتری جرمی mass spectrometry تجزیه و تحلیل میگردد.
ایمنیسنجی
مایعی پیشرفته با قابلیتهای DMF,DMF را به عنوان یک پلت فرم ایمنی سنجی پذیرفتهاست، به طوری که دستگاههای DMF بهطور دقیقی میتوانند مقادیر کمی از معرفهای مایع را دستکاری نمایند. هر دو ایمنی سنجی ناهمگن (آنتیژنهایی که با آنتیبادیهای ثابت فعل و انفعال نشان میدهند) و ایمنی سنجی همگن (آنتیژنهایی که با آنتیبادیها در محلول فعل و انفعال نشان میدهند) با پلت فرم DMF ایجاد شدهاند. با در نظر گرفتن ایمنی سنجی نا همگن، DMF میتواند از طریق اجرای همهٔ موارد مثل تحویل، امتزاج، انکوبه کردن و مراحل شستشو بر روی سطح دستگاه (روی تراشه on-chip)، مراحل طولانی و شدید فرایند را تسهیل نماید. علاوه بر این، روشهای ایمنی سنجی مانند سنجشهای برپایهٔ بیدهای مغناطیسی، ELISA، و تشخیص الکتروشیمیایی با پلت فرمهای ایمنی سنجی DMF ترکیب شدهاند.
ترکیب شدن سنجشهای برپایه بید مغناطیسی با پلت فرم ایمنی سنجی DMF برای تشخیص چندین آنالیت نشان داده شدهاست مانند انسولین انسانی، IL-6، نشانگر قلبی تروپونین I، هورمون محرک تیروئید، ۱۷ بتا استرادیول و sTNF-RI. به عنوان مثال، دیدگاه برپایه بید مغناطیسی برای تشخیص نشانگر قلبی تروپونین I از خون کامل برای کمتر از ۸ دقیقه استفاده شدهاست. بهطور خلاصه، بیدهای مغناطیسی که حاوی آنتیبادیهای اولیه هستند با آنتیبادیهای ثانویه نشاندار و آمیخته شده و برای مراحل شستشو با مغناطیس انکوبه و تثبیت گردیدند. سپس قطره با یک معرف نورافشان شیمیایی chemiluminescent reagent ترکیب شده و تشخیص واکنش آنزیمی به همراهش با لوله افزاینده نوری photomultiplier tube بر روی تراشه اندازهگیری گردید.
الگوی ELISA که معمولاً برای سنجشهای ایمنی و دیگر سنجشهای زیستشیمیایی برپایهٔ آنزیمی استفاده میشود، برای استفاده با پلتفرم DMF برای تشخیص آنالیتهایی مثل IgE و IgG پذیرفته شدهاست. در یک مثال، یک سری سنجشهای زیستی bioassays برای ایجاد قابلیتهای کمی دستگاههای DMF ایجاد شدهاست مانند سنجش ایمنی بر پایهٔ ELISA برای تشخیص IgE. ذرات نانوی سوپرمغناطیس با آنتیبادیهای ضد IgE تثبیت شده و نشاندار کردن فلوئوروسنتی آپتامرها صورت گرفته تا با استفاده از الگوی الایزا ،IgE تعیین کمیت شود. همینطور، برای تشخیص IgG , IgG میتواند بر روی تراشه DMF تثبیت شده با horseradish-peroxidase که IgG را نشاندار میکند کنژوگه شده و سپس از طریق اندازهگیری تغییر رنگ مربوط به ایجاد محصول واکنش بین HRP و تترانتیل بنزیدین تعیین کمیت شود.
برای فراتر بردن قابلیتها و کاربردهای ایمنی سنجی DMF ورای تشخیص رنگ سنجی (مانند الایزا، سنجشهای برپایه بید مغناطیس) ابزارهای تشخیص الکتروشیمیایی (مانند میکروالکترودها) با تراشههای DMF برای تشخیص آنالیتها مانند TSH و ویروس سرخجه ترکیب شدهاند. به عنوان مثال در یک تحقیق میکروالکترودها را با سطح تراشه DMF ترکیب کردند و یک سنجش ایمنی IgG با نورافشان شیمیایی را که از قبل گزارش شده بود با گونههای electroactive جابهجا کردند تا قادر به تشخیص ویروس سرخجه بشوند. در این تحقیق بیدهای مغناطیسی با ویروس سرخجه، IgG ضد سرخجه و IgG ضدانسانی به همراه آلکالین فسفاتاز، پوشیده شده که به نوبه خود واکنش انتقال الکترون را کاتالیز کرده و توسط میکروالکترودهای روی تراشه شناسایی شدند.
ریزسیالشناسی دیجیتال و طیفسنجی جرمی
ترکیب DMF و طیفسنجی (اسپکترومتری) جرمی میتواند بهطور وسیعی به تجزیه و تحلیل off-line غیر مستقیم، تجزیه و تحلیل off-line مستقیم و تجزیه و تحلیل in-line طبقهبندی بشود. از مزایای این ترکیب کاهش استفاده از حلال و معرف و کاهش زمان تجزیه و تحلیل میباشد.
تجزیه و تحلیل off-line غیرمستقیم استفاده از دستگاههای DMF برای ترکیب محصولات ایزوله و واکنش کنندهها است که پس از آن برداشته شده و به صورت دستی به اسپکترومتری جرمی منتقل میگردد. این دیدگاه از ویژگی DMF برای مراحل آمادهسازی نمونه استفاده مینماید. اما همچنین میتواند به دلیل تماس فرد برای انتقال نمونه، آلودگی ایجاد کند. در یک نمونه از این تکنیک، سه جزء تراکم Grieco برای روی تراشه انجام گرفت و با میکروپیپت برای فرونشاندن و تجزیه و تحلیل بیشتر برداشته شد.
تجزیه و تحلیل off-line مستقیم استفاده از دستگاههای DMF است که اندکی با طیفسنجی جرمی یکی شدهاست. این فرایند هنوز off-line در نظر گرفته میشود، هرچند برخی از فرایندهای پس از واکنش ممکن است به صورت دستی (اما بر روی تراشه) بدون استفاده از قابلیتهای دیجیتال دستگاه انجام گیرند، چنین دستگاههایی اغلب همراه با MALDI-MS مورد استفاده قرار میگیرند. در دستگاههای off-line مستقیم برپایهٔ MALDI، قطره بایستی خشک شده و مجدد همراه با عملیات-ماتریکسی که اغلب اوقات نیاز به اتاقک خلاء دارد بلوری (کریستالیزه) شود. تراشه با آنالیت بلوریشده در MALDI-MS برای تجزیه و تحلیل قرار میگیرد. یکی از مشکلات ترکیب MALDI-MS با DMF این است که ماتریکس مورد نیاز برای MALDI-MS میتواند بسیار اسیدی باشد و ممکن است با واکنسهای روی تراشه مداخله نماید.
تجزیه و تحلیل in-line استفاده از دستگاههایی است که خوراک مستقیم طیفسنجیهای جرمی است، در نتیجه هر دستکاری ای با دست را حذف مینماید. تجزیه و تحلیل in-line ممکن است به دستگاههای ساخته شده بخصوصی نیاز داشته باشد و سختافزاری را بین دستگاه و اسپکترومتری اتصال نماید. تجزیه و تحلیل in-line اغلب با یونیزاسیونelectrospray ترکیب میشود. در یک مثال، یک تراشه DMF با سوراخی ساخته شد که به microchannelهایی منتهی میشد. microchannel به نوبه خود به electrospray یونیزهکننده ای که به شکل مستقیم در اسپکترومتری جرمی ساطع میشد وصل میگردید. یک ترکیب دیگری که ممکن است با in-line باشد DMF و بمباران اتمی موج آکوستیکی سطحیSurface Acoustic Wave است. این روش با بهرهگیری از انتشار امواج روی سطوح تخت پیزوالکتریک قطرات یونیزه را انتقال میدهد. برخی ترکیبات از منبع پالس خارجی با ولتاژ بالا در ورودی فیزیکی اسپکترومتری جرمی استفاده میکنند. اما نقش اصلی چنین افزودنیهایی نامشخص است.
اسپکتروسکوپی رزونانس مغناطیسی هسته
اسپکتروسکوپی رزونانس مغناطیسی هسته(NMR) میتواند همراه با DMF از طریق استفاده از NMR microcoils که مارپیچهای الکترومغناطیسی هستند و کمتر از 1 میلیمتر سایزشان است، مورد استفاده قرار بگیرد. این microcoilsها محدودیتهای زیادی بخاطر سایزشان دارند که بهطور مستقیم به حساسیت دستگاهی که در آن کار میکنند اثر میگذارند.
رابط Microchannel/microcoil، قبل از ریزسیالشناسی دیجیتال، دارای چندین اشکال بود. از جمله ایجاد مقادیر زیادی حلال زائد و آلودگی. در این راه، استفاده از میکروفلوئیدیک دیجیتال و قابلیتش در دستکاری قطرات منفرد نوید دهنده میباشد.
رابط بین ریزسیالشناسی دیجیتال و NMR relaxometry منجر به ایجاد سیستمهایی شدهاست که برای تشخیص و تعیین کمیت غلظت مولکولهای بخصوصی بر روی مقیاسهای کوچک استفاده میشود. چنین سیستمهایی از دو فرایند استفاده میکنند که در آن دستگاههای DMF قطرات را بسمت محل تشخیص NMR هدایت میکند. سیستمهای معارفه ای NMR با میدان بالا و 2D NMR به همراه میکروفلوئیدیک نیز ایجاد شدهاند. این سیستمها از دستگاههای DMF با صفحه منفرد با NMR microcoils در جای صفحه دوم استفاده میکنند.
سنتز شیمیایی در ریزسیالشناسی دیجیتال
DMF دستکاریهای دقیق و هماهنگی در واکنشهای سنتز شیمیایی با مقیاس کوچک را به دلیل توانایی اش در کنترل حجمهای کمی از معرفهای مایع که سبب استفاده کمتر از معرفها و ایجاد مواد زائد کمتر میگردند، میپذیرد. این تکنولوژی میتواند در سنتز ترکیباتی ماند peptidomimetics و ردیابهای PET مورد استفاده قرار بگیرد. ردیابهای PET نیاز به مقادیر nanogram دارند بطوری که DMF، سنتز سریع ردیاب با کارامدی ۹۵–۹۰٪ را در مقایسه با تکنیکهای مقیاس بزرگ شرطی میپذیرد.
معرفهای آلی معمولاً در DMF استفاده نمیشوند، زیرا که سبب مرطوب شدن دستگاه DMF شده و میتوانند رطوبت خیلی زیادی را ایجاد کنند. با این حال، سنتز معرفهای آلی میتواند از طریق تکنیکهای DMF توسط انتقال معرفهای آلی بوسیلهٔ یک قطره مایع یونی بدست آید که مانع معرف آلی در مرطوب نمودن زیاد دستگاه بشود. قطرات با یکدیگر توسط القاء بارهای متفاوت ترکیب شده و در نتیجه یکدیگر را جذب میکنند. این روش باعث آمیختگی خودکار قطرات میشود. آمیختگی قطرات همچنین برای رسوب بلورهای MOF برای چاپ کردن از طریق آزاد کردن معرفها در چاهکها و تبخیر محلولها برای رسوب بلور مورد استفاده قرار میگیرد. این روش رسوب بلور MOF نسبتاً ارزان بوده و نیاز به تجهیزات روباتیک گرانقیمت ندارد.
دستگاههای DMF همچنین میتوانند در کشتهای سلولی مورد استفاده قرار بگیرند. روش ایمونوسیتوشیمی ریزسیالشناسی دیجیتال در سلولهای منفرد برای کشت دادن و استفاده از آنتیبادیها برای نشاندار کردن پروتئینهای فسفریله شده در سلول با استفاده از DMF ایجاد شدهاند. سپس سلولهای کشت داده شده برداشته شده و تراشه را برای غربالگری برمیدارند. تکنیک دیگر هیدروژلهایی را در پلت فرمهای DMF میسازد. این فرایند از الکترودها برای دادن معرفها در تولید هیدروژل و سپس دادن معرفهای کشت سلولی برای جذب بداخل ژل استفاده میکند. هیدروژلها پیشرفته تر از کشت سلولی دو بعدی هستند، زیرا که کشت سلولی سه بعدی فعل و انفعالات سلول به سلول را افزایش میدهد. کشتهای سلولهای کروی روش دیگری برپایهٔ توانایی DMF برای تحویل قطرات به سلولها هستند. کاربرد پتانسیل الکتریکی مجوز انتقال قطره خودکار را بهطور مستقیم به کشت سلول معلق میدهد. کشت سلول در spheroidsها بافتهای In vivo را مورد تقلید قرار میدهد. استفاده دیگر پلت فرمهای DMF در کشت سلولی، توانایی اش در هدایت سلولهای آزاد In vitro بوسیلهٔ PCR مولکولهای منفرد بداخل قطرات است. محصولات تکثیر شده PCR سپس داخل سلول با استفاده از شیب دمایی اطراف سطح پلت فرم DMF کشت داده میشوند.

![آبی قطرات نشسته در بالای یک باز و بسته دیجیتال سیستم ریزسیالشناسی با مقطع مشاهده است. این نشان می دهد حرکت قطرات هنگامی که یک الکترود فعال است. طراحی دستگاه می توان دستکاری به تناسب نیاز کاربر (اصلاح الکترود الکترود الگوی مواد مورد استفاده و غیره.).[3][4]]]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/83/DMF_open_and_closed_system.pdf/page1-577px-DMF_open_and_closed_system.pdf.jpg)