ایکسازومیب
 | |
| دادههای بالینی | |
|---|---|
| نامهای تجاری | Ninlaro |
| نامهای دیگر | MLN2238 |
| AHFS/Drugs.com | entry |
| دادهها | |
| روش مصرف دارو | خوراکی (کپسول) |
| کد ATC | |
| وضعیت قانونی | |
| وضعیت قانونی |
|
| دادههای فارماکوکینتیک | |
| زیست فراهمی | ۵۸٪ |
| پیوند پروتئینی | ۹۹٪ |
| متابولیسم | کبدی (CYP: 3A4 (۴۲٪)، 1A2 (۲۶٪)، 2B6 (۱۶٪) و بقیه) |
| نیمهعمر حذف | ۹٫۵ روز |
| دفع | ادرار (۶۲٪)، مدفوع (۲۲٪) |
| شناسهها | |
| |
| شمارهٔ سیایاس | |
| پابکم CID | |
| دراگبنک | |
| کماسپایدر | |
| UNII | |
| KEGG | |
| ChEBI | |
| ECHA InfoCard | 100.238.319 |
| دادههای فیزیکی و شیمیایی | |
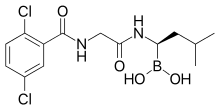
| فرمول شیمیایی | C14H19BCl2N2O۴ |
| جرم مولی | ۷۰۰۲۳۶۱۰۳۰۰۰۰۰۰۰۰۰۰♠۳۶۱٫۰۳ g·mol−1 |
| مدل سه بعدی (جیمول) | |
| |
| |
ایکسازومیب (انگلیسی: Ixazomib) با نام تجاری نینلارو (انگلیسی: Ninlaro) دارویی است که برای درمان مولتیپل میلوما بکار میرود که نوعی سرطان گلبول سفید است.
این دارو توسط شرکت تاکدا ساخته شدهاست و در آمریکا از نوامبر ۲۰۱۵ و در اروپا از نوامبر ۲۰۱۶ مورد پذیرش و استفاده واقع شدهاست.
موارد مصرف
این دارو در ترکیب با لنالیدوماید و دگزامتازون، برای درمان مولتیپل میلوما در بالغینی که دستکم یکبار شمیدرمانی شدهاند، بکار میرود. این دارو هنوز در کودکان و نوجوانان کمتر از ۱۸ سال تجربه نشدهاست. در مطالعات حیوانی، ایکسازومیب و لنالیدوماید هر دو، تراتوژن بودهاند. لنالیدوماید در زنان باردار، منع مصرف دارد و در نتیجه رژیم سهدارویی یادشده، برای بیماران باردار نامناسب و غیرقابل انجام است. هنوز مشخص نیست که ایکسازومیب و متابولیتهایش به شیرِ درونِ پستان نفوذ میکنند یا خیر.
عوارض جانبی
عوارض شایعِ ترکیب سهدارویی ایکسازومیب، لنالیدوماید و دگزامتازون، اسهال، ترومبوسیتوپنی، پلینوریت، تهوع، ادم محیطی، استفراغ و پشتدرد است. اسهال، ترومبوسیتوپنی شدید و جدی تنها در ۲٪ بیماران رخ میدهد.
عوارض جانبی ایکسازومیب به تنهایی، در شمار اندکی از بیماران ارزیابی شدهاست و شامل اسهال درجه ۲ و بالاتر (در ۲۴٪ موارد)، ترومبوسیتوپنی درجه ۳ و بالاتر (در ۲۸٪ موارد) و خستگی درجه یا بالاتر (در ۲۶٪ موارد) است.
تداخلات دارویی
این دارو بهطور بالقوه میتواند با آنزیمهای سیتوکروم پی ۴۵۰ کبد و حاملهای پروتئینی تداخل دارد. در بررسیهای بعملآمده، مصرف همزمان با ریفامپین (که القاکنندهٔ پرقدرت آنزیم CYP3A4 کبد است)، سطح خونی ایکسازومیب را کاهش داد.
داروشناسی
مکانیسم اثر
همچون داروی بورتزومیب، ایکسازومیب نیز بازدارنده پروتئازوم است. این دارو بهطور انتخابی و قابلبازگشت پروتئین PSMB5 را مهار میکند و نیمهعمر تفکیک آن ۱۸ دقیقه است. (در مقایسه، نیمهعمر تفکیک بورتزومیب ۱۱۰ دقیقه است) داروی کارفیلزومیب پروتئین PSMB5 را بهطور غیرقابلبازگشت مهار میکند. مهار پروتئینهای PSMB1 و PSMB2 تنها در مطالعات آزمایشگاهی و در غلطتهای بالای ایکسازومیب رخ دادهاست.
پروتئین PSMB5 بخشی از کمپلکس مرکزی و اصلی 20S در پروتئازوم است و فعالیت آنزیمی مشابه کیموتریپسین دارد. این پروتئین، آپوپتوز را القا میکند. پژوهشها نشان میدهد که ترکیب داروی ایکسازومیب و لنالیدوماید، اثر همافزایی در برابر بیشترِ ردههای سلولهای سرطانیِ مولتیپل میلوما دارند.
فارماکوکینتیک
این دارو بهصورت خوراکی (کپسول) مصرف میشود که حاوی پیشداروی «ایکسازومیب سیترات» است که نوعی اِسترِ بورونیک اسید محسوب میشود. سپس در بدن به سرعت متابولیزه شده و به فرمِ فعالش یعنی ایکسازومیب مبدل میشود که نوعی بورونیک اسید است.فراهمی زیستی مطلق این دارو ۵۸٪ است و بالاترین سطح پلاسمایی آن پس از ۱ ساعت حاصل میشود. پیوند پروتئینی ایکسازومیب در حدود ۹۹٪ است.
بسیاری از آنزیمهای کبدی، در تجزیهٔ این دارو شرکت دارند. کلیرانس ایکسازومیب در حدود ۱٫۸۶ لیتر در ساعت با تغییرپذیری گسترده در افراد گوناگون (حدود ۴۴٪) است. نیمهعمر این دارو، ۹٫۵ روز است. ۶۲٪ از ایکسازومیب و متابولیتهایش از طریق ادرار (کمتر از ۳٫۵٪ آن بدون تغییر) و در حدود ۲۲٪ از طریق مدفوع دفع میشود.
پژوهشها
در حال حاضر چند کارآزمایی بالینی فاز ۳ برای استفاده از ایکسازومیب در درمانِ «آمیلوئیدوز نوعِ AL" و همچنین «پلاسماسایتومای استخوان» (نوعی سرطان پلاسماسل) در جریان است. چند کارآزماییِ بالینیِ فاز ۱ و ۲ نیز برای چندین بیماری دیگر در حالِ انجام است.
- مشارکتکنندگان ویکیپدیا. «Ixazomib». در دانشنامهٔ ویکیپدیای انگلیسی، بازبینیشده در ۴ آوریل ۲۰۱۸.
